题目内容
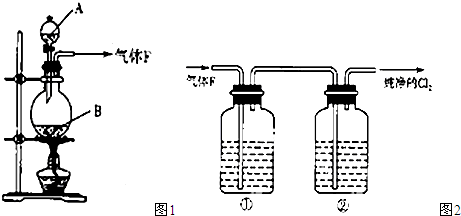
如图1所示,某兴趣小组同学将铜片加入稀硝酸,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。

图 1 图 2
(1)图1中铜与稀硝酸反应的离子方程式为 ;
用离子方程式表示NaOH溶液所起的作用 ;
(2)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是 ;
测定反应过程中溶液不同时间的温度,结果如下表:
|
时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
35 |
50 |
60 |
70 |
80 |
|
温度/℃ |
25 |
26 |
26 |
26 |
26 |
26 |
26.5 |
27 |
27 |
27 |
27 |
结合实验目的和表中数据,你得出的结论是 ;
Ⅱ.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的 (填序号)。
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。因此得出结论:Cu2+并不是反应的催化剂。
Ⅲ. 丙同学根据现象推测反应过程中还有少量 生成,进而认为该物质对反应有催化作用,如图2所示,实验中丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
(3)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中硝酸铜的质量分数较高所致,另一部分同学认为是该溶液中溶解了通入的物质。请你设计一个实验方案来证明哪种假设正确。(写出实验操作、实验现象和结论) 。
(1)3Cu + 8H+ + 2NO3−=3Cu2+ + 2NO↑ + 4H2O (2分)
NO + NO2 + 2OH−=2NO2− + H2O(2分)
(2)Ⅰ.温度计 (2分) 温度不是速率明显加快的主要原因(2分)
Ⅱ.A(2分) Ⅲ.NO2 (2分)
(3) 加热该绿色溶液,观察颜色变化(或向该绿色溶液中通入氮气,观察颜色变化或向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化)(2分)
【解析】
试题分析:(1)硝酸具有强氧化性,稀硝酸的还原产物是NO,所以图1中铜与稀硝酸反应的离子方程式为3Cu + 8H+ + 2NO3−=3Cu2+ + 2NO↑ + 4H2O。反应中液面上方的气体颜色也在不断加深,这是由于NO被氧化生成了红棕色的NO2。不论是NO还是NO2都是大气污染物,需要尾气处理,所以氢氧化钠溶液的作用是吸收NO和NO2,防止污染空气,反应的离子方程式为NO + NO2 + 2OH−=2NO2− + H2O。
(2)I、如果是因为反应放热导致溶液温度升高所致,则必须测量溶液的温度,因此完成此实验还需要的仪器是温度计。根据表中数据可知,80min内溶液的温度只上升了2℃,这说明随着反应的进行,溶液的温度变化不明显,因此温度不是速率明显加快的主要原因。
Ⅱ、为验证铜离子是否有催化作用,作对比实验,在一支试管中加入含有铜离子的盐,一支试管中不加铜盐,然后比较反应速率,根据反应速率大小确定假设是否正确。为防止阴离子对实验的干扰,最好选择硝酸铜晶体,答案选A。
Ⅲ、根据液面上方的气体颜色也在不断加深可推断反应过程中还有少量NO2生成。
(3)如果试管中溶液呈绿色,而不显蓝色。是由于NO2引起的,则可以将将绿色的混合溶液加热,若能放出红棕色气体、且溶液变蓝色,说明这个假设正确或将NO2气体通入蓝色硝酸铜溶液中观察溶液颜色是否变绿色。
考点:考查铜与稀硝酸反应原理的实验探究、实验方案设计与评价等

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案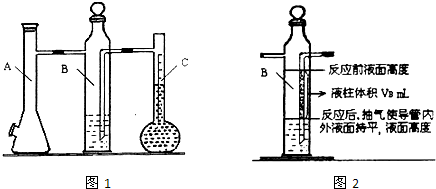
实验步骤:
(1)装配好化学反应气体体积测定仪,作气密性检查.
(2)用砂皮擦去镁带表面的氧化物,然后称取0.100g~0.110g的镁带,把数据记录于表格.
(3)取下A瓶加料口的橡皮塞,用小烧杯加入20mL水,再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧加料口.
(4)用注射器从A瓶加料口处抽气,使B瓶导管内外液面持平.
(5)用注射器吸取10mL 3mol/L硫酸,用针头扎进A瓶加料口橡皮塞,将破酸注入A瓶,注入后迅速拔出针头.
(6)当镁带完全反应后,读取C瓶中液体的体积,把数据记录于表格.
(7)用注射器从A瓶加料口处抽气,使B瓶中导管内外液面持平,记录抽出气体的体积,把数据记录于表格.
重复上述操作进行第二次实验,避免偶然误差.
根据上述实验方法回答下列问题:
实验室温度:25℃,压强:101kPa.该条件下1mol氢气体积的理论值:为24.5L
(1)连接装置及气密性检查:当A瓶加料口塞上橡胶塞,
(2)B中所装液体一般是
(3)实验数据如下:温度:25℃(镁元素的相对原子质量为24.3)
| 实验次数 | m(Mg)/g | 硫酸体积/mL | 液体量瓶中液体体积/mL | 抽出气体体积/mL | 氢气体积/mL | 计算1mol氢体积/L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | X | |
| 2 | 0.115 | 10.0 | 121.0 | 8.0 |
②计算1mol氢气体积两次实验的平均值=
③计算实验误差:(实验值-理论值)/理论值×100%=
④引起该误关的可能原因
A.镁带中含有跟硫酸不反应的杂质
B.没有除去镁带表面的氧化镁
C.镁带中含有杂质铝
D.所用稀硫酸不足量
(4)许多同学在实验中测得的数据偏高(记录数据时已恢复至室温).为此,某化兴趣小组的同学对此实验方案提出了两条修正建议:
①A、B瓶的气体中含有水汽,增加的气体体积中所含的水汽,不该计入氢气的体积.
②B瓶中导管(图2中阴影部分VB)内液柱部分在反应后为空气所占据,不该计入氢气的体积.
你认为他们的意见合理的是
| 实验次数 | m(Mg) g |
硫酸体积mL | 液体量瓶中液体体积mL | 抽出气体体积mL | B瓶的一段液柱体积mL | 水汽体积百分含量 | 计算1mol氢体积L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | VB | a% |

 CH3COOH+OH-
CH3COOH+OH-