题目内容
实验室中所用少量氯气是用下列方法制取的:
4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
(1)该反应既是离子反应也是氧化还原反应。该反应的还原剂是 (用化学式表示)。
氯气有毒会污染空气,实验室常用氢氧化钠吸收该实验的尾气,写出用氢氧化钠溶液吸收氯气的离子方程式 。
(2)若有17.4gMnO2与足量的浓盐酸充分反应后, 所得溶液的体积为500 mL,求:
①转移电子数为______ _;
②被氧化的HCl的物质的量_______ mol;
4HCl(浓)+MnO2
 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O(1)该反应既是离子反应也是氧化还原反应。该反应的还原剂是 (用化学式表示)。
氯气有毒会污染空气,实验室常用氢氧化钠吸收该实验的尾气,写出用氢氧化钠溶液吸收氯气的离子方程式 。
(2)若有17.4gMnO2与足量的浓盐酸充分反应后, 所得溶液的体积为500 mL,求:
①转移电子数为______ _;
②被氧化的HCl的物质的量_______ mol;
(1)HCl Cl2+2 OH-=Cl-+ClO-+H2O (2)①0.4 NA ② 0.4
试题分析:(1)在反应4HCl(浓)+MnO2
 Cl2↑+MnCl2+2H2O中,氯元素的化合价从-1价升高到0价,失去电子,被氧化,因此氯化氢是还原剂。Mn元素的化合价从+4价降低到+2价,得到电子,被还原,所以二氧化锰是氧化剂。氯气有毒,需要尾气处理,氢氧化钠溶液能吸收氯气,反应的离子方程式为Cl2+2 OH-=Cl-+ ClO-+H2O。
Cl2↑+MnCl2+2H2O中,氯元素的化合价从-1价升高到0价,失去电子,被氧化,因此氯化氢是还原剂。Mn元素的化合价从+4价降低到+2价,得到电子,被还原,所以二氧化锰是氧化剂。氯气有毒,需要尾气处理,氢氧化钠溶液能吸收氯气,反应的离子方程式为Cl2+2 OH-=Cl-+ ClO-+H2O。(2)①隔绝n=
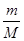 可知,17.4gMnO2的物质的量=17.4g÷87g/mol=0.2mol。在反应中Mn元素的化合价从+4价降低到+2价,得到2个电子,所以0.2mol二氧化锰得到0.4mol电子,因此转移电子的个数是0.4 NA。
可知,17.4gMnO2的物质的量=17.4g÷87g/mol=0.2mol。在反应中Mn元素的化合价从+4价降低到+2价,得到2个电子,所以0.2mol二氧化锰得到0.4mol电子,因此转移电子的个数是0.4 NA。②1mol氯化氢在反应中失去1mol电子,所以0.2mol二氧化锰能氧化氯化氢的物质的量是0.4mol。

练习册系列答案
相关题目
 6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( ) )mol
)mol MnCl2 + Cl2↑ + 2H2O。
MnCl2 + Cl2↑ + 2H2O。