题目内容
铜是生物必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式____________________________________________________。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式__________________________________________________。
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+ Cu2S 6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜诱的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式__________________________。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取ag试样配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式________________________________________。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为:I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗cmol/L的Na2S2O3溶液VmL。则试样中CuSO4·5H2O的质量分数为____________。
(1)写出铜与稀硝酸反应的化学方程式____________________________________________________。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式__________________________________________________。
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+ Cu2S
 6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜诱的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式__________________________。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取ag试样配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式________________________________________。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为:I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗cmol/L的Na2S2O3溶液VmL。则试样中CuSO4·5H2O的质量分数为____________。
(14分)(1)3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑(2分)
(2)Cu+H2O2+2H+=Cu2++2H2O(2分)(3)Cu2O和Cu2S(2分) 0.3(2分)
(4)2Cu+4OH-+CO2-4e-=Cu2(OH)2CO3+H2O(2分)(若写成Cu-2e-=Cu2+得1分)
(5)2Cu2++4I-=2CuI↓+I2(2分)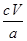 ×100%(2分)
×100%(2分)
(2)Cu+H2O2+2H+=Cu2++2H2O(2分)(3)Cu2O和Cu2S(2分) 0.3(2分)
(4)2Cu+4OH-+CO2-4e-=Cu2(OH)2CO3+H2O(2分)(若写成Cu-2e-=Cu2+得1分)
(5)2Cu2++4I-=2CuI↓+I2(2分)
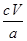 ×100%(2分)
×100%(2分)试题分析:(1)硝酸是氧化性酸,能氧化大部分金属,因此铜与稀硝酸反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑。
(2)双氧水具有氧化性,在酸性条件下能被铜氧化成铜离子,而双氧水的还原产物是水,因此溶出铜的离子方程式为Cu+H2O2+2H+=Cu2++2H2O。
(3)根据方程式2Cu2O+ Cu2S
 6Cu+SO2可知,反应中铜元素的化合价从+1价降低到0价,得到1个电子,因此氧化剂是该反应的氧化剂是Cu2O和Cu2S;S元素的化合价从-2价升高到+4价,失去6个电子,即Cu2S是还原剂。19.2gCu的物质的量=
6Cu+SO2可知,反应中铜元素的化合价从+1价降低到0价,得到1个电子,因此氧化剂是该反应的氧化剂是Cu2O和Cu2S;S元素的化合价从-2价升高到+4价,失去6个电子,即Cu2S是还原剂。19.2gCu的物质的量=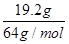 =0.3mol,则当生成19.2gCu时,反应中转移的电子的物质的量=0.3mol×1=0.3mol。
=0.3mol,则当生成19.2gCu时,反应中转移的电子的物质的量=0.3mol×1=0.3mol。(4)原电池中负极失去电子,发生氧化反应。所以生成铜锈的过程中负极的电极反应式为2Cu+4OH-+CO2-4e-=Cu2(OH)2CO3+H2O。
(5)滴加KI溶液后有白色碘化物沉淀生成,这说明反应中铜元素的化合价从+2价降低+1价,得到1个电子。而反应中碘离子失去电子被氧化生成单质碘,因此该反应的离子方程式为2Cu2++4I-=2CuI↓+I2;根据方程式2Cu2++4I-=2CuI↓+I2、I2+2Na2S2O3=2NaI+Na2S4O6可知:
CuSO4·5H2O~Na2S2O3
1 1
0.001cVmol 0.001cVmol
所以ag试样中CuSO4·5H2O的物质的量=0.001cVmol×
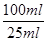 =0.004cVmol
=0.004cVmol质量=0.004cVmol×250g/mol=cVg
因此试样中CuSO4·5H2O的质量分数为
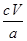 ×100%
×100%
练习册系列答案
相关题目
 Fe3O4+S4O62-+2H2O,有关说法正确的是
Fe3O4+S4O62-+2H2O,有关说法正确的是 CO(NH2)2 (l) + H2O (l)。
CO(NH2)2 (l) + H2O (l)。 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
 CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。 2H2↑+O2↑。其中(填序号):
2H2↑+O2↑。其中(填序号): Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O