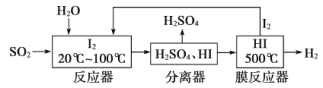
题目内容
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。
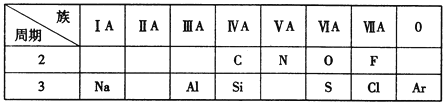
(1)化学性质最不活泼的元素是____(填元素名称);
(2)氮原子的一种氢化物常用作燃料电池的燃料,其电子式为________;
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是_________(填化学式);
(4)碳原子的氢化物和氯气在光照条件下发生第一步反应的化学方程式是_____________;
(5)第3周期中气态氢化物最稳定的是________;(填化学式);
(6)Si是带来人类文明的重要元素之一,晶体硅的主要用途是___________(写出一种).
(7)Na、Al最高价氧化物的水化物之间反应的产物通入少量二氧化碳,发生反应的离子方程式是_________________________________.
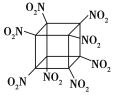
(8)结构式为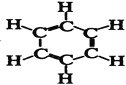 的有机物分子式是______,其中碳元素与氢元素的质量比m(C)∶m(H)=________(相对原子质量:H—1 C—12)。
的有机物分子式是______,其中碳元素与氢元素的质量比m(C)∶m(H)=________(相对原子质量:H—1 C—12)。
【答案】氩 ![]() HClO4 CH4+Cl2
HClO4 CH4+Cl2 ![]() CH3Cl+HCl HCl 集成电路、半导体等 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- C6H6 12:1
CH3Cl+HCl HCl 集成电路、半导体等 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- C6H6 12:1
【解析】
(1)稀有气体单质的化学性质最不活泼;
(2)氮原子的一种氢化物常用作燃料电池的燃料,该燃料为肼,据此分析书写肼的电子式;
(3)非金属性越强,最高价氧化物对应水化物酸性越强;
(4)碳原子的氢化物为甲烷,甲烷与氯气发生取代反应生成一氯甲烷和HCl;
(5)非金属性越强,气态氢化物越稳定;
(6)硅是良好的半导体材料;
(7)Na、Al最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠,在偏铝酸钠溶液中通入少量二氧化碳生成氢氧化铝沉淀和碳酸钠,据此书写反应的离子方程式;
(8)根据结构式,该有机物中含有6个C原子和6个H原子,据此分析解答。
(1)稀有气体单质的化学性质最不活泼,所给10种元素中只有Ar为稀有气体,故答案为:氩;
(2)氮原子的一种氢化物常用作燃料电池的燃料,该燃料为肼,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)非金属性越强,最高价氧化物对应水化物酸性越强,第3周期元素中,Cl元素非金属性最强,故HClO4的酸性最强,故答案为:HClO4;
(4)碳原子的氢化物为甲烷,甲烷与氯气在光照的条件下发生取代反应,第一步是1个氯原子替换出1个氢原子,另一个氯原子则与氢原子结合生成氯化氢,反应方程式为CH4+Cl2 ![]() CH3Cl+HCl,故答案为:CH4+Cl2
CH3Cl+HCl,故答案为:CH4+Cl2 ![]() CH3Cl+HCl;
CH3Cl+HCl;
(5)非金属性越强,气态氢化物越稳定,第3周期元素中,Cl元素非金属性最强,气态氢化物最稳定的是HCl,故答案为:HCl;
(6)晶体硅的主要用途是:集成电路、半导体、太阳能电池板等,故答案为:集成电路、半导体等;
(7)Na、Al最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应的化学方程式为Al(OH)3 + NaOH=NaAlO2 + 2H2O,在偏铝酸钠溶液中通入少量二氧化碳,反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(8)根据结构式,该有机物中含有6个C原子和6个H原子,分子式为C6H6,其中m(C)∶m(H)=12×6∶1×6=12∶1;故答案为:C6H6;12∶1。

【题目】下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
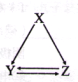
选项 | X | Y | Z |
A | AlCl3 | Al(OH)3 | NaAlO2 |
B | C | CO | CO2 |
C | CH2=CH2 | CH3CH2Br | CH3CH2OH |
D | S | SO2 | SO3 |
A.AB.BC..CD.D