题目内容
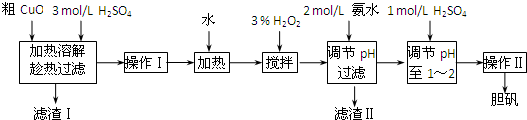
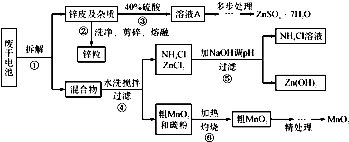
B.《实验化学》粗CuO是将工业废铜、废电线及废铜合金高温焙烧而成的,杂质主要是铁的氧化物及泥沙.以粗CuO为原料制备CuSO4?5H2O的主要步骤如下图所示:
Fe3+、Fe2+、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
(1)加入3% H2O2之前需将热溶液冷却,其目的是 ,H2O2的作用是 .
(2)加入2mol/L氨水后,溶液的pH应在 范围内.
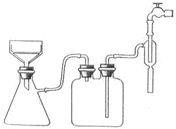
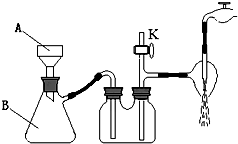
(3)经操作Ⅰ得到粗胆矾,经操作Ⅱ得到精制胆矾.两步操作相同,都包括 、抽滤、洗涤、干燥等步骤.某同学装配的抽滤装置如下图所示,该装置中的错误之处是 .
(4)调节溶液的pH常选用稀酸或稀碱,而不用浓酸、浓碱,理由是 .

Fe3+、Fe2+、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
(2)加入2mol/L氨水后,溶液的pH应在
(3)经操作Ⅰ得到粗胆矾,经操作Ⅱ得到精制胆矾.两步操作相同,都包括

(4)调节溶液的pH常选用稀酸或稀碱,而不用浓酸、浓碱,理由是
分析:(1)双氧水具有氧化性,在加热条件下会发生分解反应生成水以及氧气;
(2)根据流程和目的,加氨水调节pH值目的是让三价铁离子沉淀,但是铜离子不沉淀;
(3)蒸发浓缩、冷却结晶可以获得物质的晶体,根据抽滤装置的原理来回答;
(4)调节溶液的pH常选用稀酸或稀碱,而不用浓酸、浓碱,浓度太大,量控制起来麻烦.
(2)根据流程和目的,加氨水调节pH值目的是让三价铁离子沉淀,但是铜离子不沉淀;
(3)蒸发浓缩、冷却结晶可以获得物质的晶体,根据抽滤装置的原理来回答;
(4)调节溶液的pH常选用稀酸或稀碱,而不用浓酸、浓碱,浓度太大,量控制起来麻烦.
解答:解:(1)双氧水具有氧化性,可以将亚铁离子氧化为铁离子,在加热条件下双氧水会发生分解反应生成水以及氧气,
故答案为:防止双氧水分解;将亚铁离子氧化为铁离子,使之在铜离子之前沉淀;
(2)根据流程和目的,加氨水调节pH值目的是让三价铁离子沉淀,但是铜离子不沉淀,根据表中的数据,三价铁离子沉淀完全的pH是3.2,铜离子开始沉淀的pH为4.7,所以调节的pH范围是3.2~4.7,
故答案为:3.2~4.7;
(3)经操作Ⅰ得到粗胆矾,经操作Ⅱ得到精制胆矾,两步操作都包括蒸发浓缩、冷却结晶,抽滤装置中,布氏漏斗的颈口斜面未朝向抽滤瓶的支管口,以保证得到要抽滤的物质,故答案为:蒸发浓缩、冷却结晶;布氏漏斗的颈口斜面未朝向抽滤瓶的支管口;
(4)调节溶液的pH常选用稀酸或稀碱,而不用浓酸、浓碱,浓度太大,因为稀的酸碱溶液便于控制加入酸或是碱的量,而浓的酸碱的量控制起来麻烦,故答案为:便于控制加入酸或是碱的量.
故答案为:防止双氧水分解;将亚铁离子氧化为铁离子,使之在铜离子之前沉淀;
(2)根据流程和目的,加氨水调节pH值目的是让三价铁离子沉淀,但是铜离子不沉淀,根据表中的数据,三价铁离子沉淀完全的pH是3.2,铜离子开始沉淀的pH为4.7,所以调节的pH范围是3.2~4.7,
故答案为:3.2~4.7;
(3)经操作Ⅰ得到粗胆矾,经操作Ⅱ得到精制胆矾,两步操作都包括蒸发浓缩、冷却结晶,抽滤装置中,布氏漏斗的颈口斜面未朝向抽滤瓶的支管口,以保证得到要抽滤的物质,故答案为:蒸发浓缩、冷却结晶;布氏漏斗的颈口斜面未朝向抽滤瓶的支管口;
(4)调节溶液的pH常选用稀酸或稀碱,而不用浓酸、浓碱,浓度太大,因为稀的酸碱溶液便于控制加入酸或是碱的量,而浓的酸碱的量控制起来麻烦,故答案为:便于控制加入酸或是碱的量.
点评:本题是一道化学工艺流程和实验相结合的综合考查题,要求学生具有分析和解决问题的能力,难度大.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
 【实验化学】
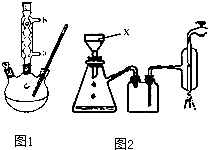
【实验化学】苯甲酸常用于抗真菌及消毒防腐.实验室常用高锰酸钾氧化甲苯制备苯甲酸,其装置如图1所示(加热、搅拌和仪器固定装置均已略去).实验过程如下:
①将5.4mL甲苯、100mL水、几粒沸石加入250mL三颈瓶中.
②装上冷凝管,加热至沸后分批加入16g高锰酸钾,回流反应4h.
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中.
④滤液加入盐酸酸化后,抽滤(装置如图2)、洗涤、干燥得苯甲酸粗产品.
在苯甲酸制备过程中发生反应:
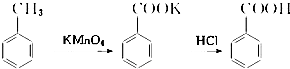
(1)图1冷凝管中冷水应从
(2)实验中分批加入KMnO4的原因是
(3)判断甲苯被氧化完全的实验现象是
(4)抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是
(5)第一次过滤时,若溶液呈红色,可加入下列试剂处理
A.H2O B.CCl4 C.NaHSO3 D.HNO3
(6)苯甲酸在不同温度下溶解度见下表:
| T/℃ | 4 | 18 | 75 |
| 溶解度/g | 0.18 | 0.27 | 2.20 |

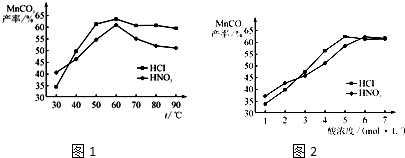
 高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.
高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.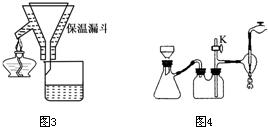 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.