题目内容
 高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.
高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.(1)写出实验室制取高氯酸钾的化学方程式:
(2)用蒸馏水多次洗涤晶体的目的是
(3)称取29.8gKCl和34.0gNaNO3放入250mL烧杯中,再加入70.0g蒸馏水,制备KNO3晶体,I,使固体全部溶解.II,在100°C时蒸发掉50.0g水,维持该温度,趁热过滤析出晶体m1g.III,冷却结晶:待滤液冷却至室温(实验时室温为10°C)后,进行减压过滤.得KNO3粗产品m2g.IV,重结晶得KNO3纯品m3g.
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
| NaNO3 | KNO3 | NaCl | KCl | |
| 10°C | 80.5 | 20.9 | 35.7 | 31.0 |
| 100°C | 175 | 246 | 39.1 | 56.6 |
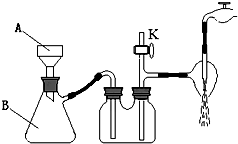
②该装置有三处错误,分别是
③若实验过程中发现倒吸现象,应采取的措施是
(4)KNO3晶体纯品的产率
分析:(1)依据题干信息和图表中溶解度大小分析判断写出反应化学方程式;
(2)用蒸馏水多次洗涤晶体的目的是洗去晶体表面的杂质;
(3)①减压过滤的操作优点是:可加快过滤速度,并能得到较干燥的沉淀;根据图片判断所用仪器;
②依据减压过滤的操作要点进行解答;
③若实验过程中发现倒吸现象,应采取的措施是打开开关阀K或拔掉吸滤瓶与安全瓶之间的橡胶管;
(4)先根据氯化钾和硝酸钠的质量计算其物质的量,把氯化钾和硝酸钠的混合溶液看成氯化钠和硝酸钾的混合溶液,求出理论产出硝酸钾的质量,根据100℃时,硝酸钾的溶解度判断是否析出硝酸钾及析出的固体质量;再根据10℃时硝酸钾的溶解度判断是否有固体析出及析出的固体质量,然后求KNO3晶体纯品的产率;
(2)用蒸馏水多次洗涤晶体的目的是洗去晶体表面的杂质;
(3)①减压过滤的操作优点是:可加快过滤速度,并能得到较干燥的沉淀;根据图片判断所用仪器;
②依据减压过滤的操作要点进行解答;
③若实验过程中发现倒吸现象,应采取的措施是打开开关阀K或拔掉吸滤瓶与安全瓶之间的橡胶管;
(4)先根据氯化钾和硝酸钠的质量计算其物质的量,把氯化钾和硝酸钠的混合溶液看成氯化钠和硝酸钾的混合溶液,求出理论产出硝酸钾的质量,根据100℃时,硝酸钾的溶解度判断是否析出硝酸钾及析出的固体质量;再根据10℃时硝酸钾的溶解度判断是否有固体析出及析出的固体质量,然后求KNO3晶体纯品的产率;
解答:解:(1)实验室制取高氯酸钾的步骤为:称取一定质量的KCl、NaClO4溶解,然后混合,氯酸钾溶解度小于氯酸钠,反应得到氯酸钾,反应的化学方程式为NaClO4+KCl═KClO4↓+NaCl;经冷却、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到;
故答案为:NaClO4+KCl═KClO4↓+NaCl;
(2)用蒸馏水多次洗涤晶体的目的是洗去晶体表面的可溶性的杂质如钠离子、氯离子等,
故答案为:尽可能除去溶解度较大的杂质;
(3)①操作III中采用减压过滤操作优点是:可加快过滤速度,并能得到较干燥的沉淀.根据图片知,仪器A和B的名称分别是布氏漏斗和吸滤瓶,
故答案为:布氏漏斗和吸滤瓶;
②布氏漏斗上的橡胶塞插入吸滤瓶内不能太长,为了防止液体沿着漏斗下端从支管口抽进去,需布氏漏斗的颈口斜面与吸滤瓶支管口相对,安全瓶内左侧导管不能太长,
故答案为:布氏漏斗上的橡胶塞插入吸滤瓶内过长、布氏漏斗的颈口斜面未与吸滤瓶支管口相对、安全瓶内左侧导管太长;
③若实验过程中发现倒吸现象,应采取的措施是打开开关阀K或拔掉吸滤瓶与安全瓶之间的橡胶管,
故答案为:打开开关阀K或拔掉吸滤瓶与安全瓶之间的橡胶管;
(4)29.8g KCl的物质的量=
=0.4mol;34.0g NaNO3的物质的量=
=0.4mol
氯化钾和硝酸钠不反应,所以氯化钾和硝酸钠的混合溶液可看作是氯化钠和硝酸钾的混合溶液,硝酸钾和氯化钠的物质的量还是0.4mol,硝酸钾的质量为40.4g,氯化钠的质量为23.4g.100℃时,20g水中溶有硝酸钾的质量为246g×
=49.2g>40.4g,所以硝酸钾形成的是不饱和溶液,10℃时,20g水中溶有硝酸钾的质量为20.9g×
=4.18g<40.4g,所以析出硝酸钾的质量为40.4g-4.18g=36.22g;所以KNO3晶体纯品的产率
×100%=89.65%
故答案为:89.65%;
故答案为:NaClO4+KCl═KClO4↓+NaCl;
(2)用蒸馏水多次洗涤晶体的目的是洗去晶体表面的可溶性的杂质如钠离子、氯离子等,
故答案为:尽可能除去溶解度较大的杂质;
(3)①操作III中采用减压过滤操作优点是:可加快过滤速度,并能得到较干燥的沉淀.根据图片知,仪器A和B的名称分别是布氏漏斗和吸滤瓶,
故答案为:布氏漏斗和吸滤瓶;
②布氏漏斗上的橡胶塞插入吸滤瓶内不能太长,为了防止液体沿着漏斗下端从支管口抽进去,需布氏漏斗的颈口斜面与吸滤瓶支管口相对,安全瓶内左侧导管不能太长,
故答案为:布氏漏斗上的橡胶塞插入吸滤瓶内过长、布氏漏斗的颈口斜面未与吸滤瓶支管口相对、安全瓶内左侧导管太长;
③若实验过程中发现倒吸现象,应采取的措施是打开开关阀K或拔掉吸滤瓶与安全瓶之间的橡胶管,
故答案为:打开开关阀K或拔掉吸滤瓶与安全瓶之间的橡胶管;
(4)29.8g KCl的物质的量=
| 29.8g |
| 74.5g/mol |
| 34.0g |
| 85g/mol |
氯化钾和硝酸钠不反应,所以氯化钾和硝酸钠的混合溶液可看作是氯化钠和硝酸钾的混合溶液,硝酸钾和氯化钠的物质的量还是0.4mol,硝酸钾的质量为40.4g,氯化钠的质量为23.4g.100℃时,20g水中溶有硝酸钾的质量为246g×
| 1 |
| 5 |
| 1 |
| 5 |
| 36.22g |
| 40.4g |
故答案为:89.65%;
点评:本题考查了物质的分离和提纯等知识点,综合性较强,掌握减压过滤操作、有关结晶的计算是解答本题的关键,本题难度较大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
 高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.
高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.
(1)写出实验室制取高氯酸钾的化学方程式:______.
(2)用蒸馏水多次洗涤晶体的目的是______.
(3)称取29.8gKCl和34.0gNaNO3放入250mL烧杯中,再加入70.0g蒸馏水,制备KNO3晶体,I,使固体全部溶解.II,在100°C时蒸发掉50.0g水,维持该温度,趁热过滤析出晶体m1g.III,冷却结晶:待滤液冷却至室温(实验时室温为10°C)后,进行减压过滤.得KNO3粗产品m2g.IV,重结晶得KNO3纯品m3g.
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
| NaNO3 | KNO3 | NaCl | KCl | |
| 10°C | 80.5 | 20.9 | 35.7 | 31.0 |
| 100°C | 175 | 246 | 39.1 | 56.6 |
②该装置有三处错误,分别是______,
③若实验过程中发现倒吸现象,应采取的措施是______.
(4)KNO3晶体纯品的产率______.
高氯酸钾广泛用于火箭及热电池业。实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到。
(1)写出实验室制取高氯酸钾的化学方程式:___ _。
(2)用蒸馏水多次洗涤晶体的目的是______________ __。
(3)称取29.8gKCl和34.0gNaNO3放入250mL烧杯中,再加入70.0g蒸馏水,制备KNO3晶体, I、使固体全部溶解。II、在100oC时蒸发掉50.0g水,维持该温度,趁热过滤析出晶体![]() 。III、冷却结晶:待滤液冷却至室温(实验时室温为10oC)后,进行减压过滤。得KNO3粗产品
。III、冷却结晶:待滤液冷却至室温(实验时室温为10oC)后,进行减压过滤。得KNO3粗产品![]() 。IV、重结晶得KNO3纯品
。IV、重结晶得KNO3纯品![]() 。
。
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
| NaNO3 | KNO3 | NaCl | KCl | |
| 10oC | 80.5 | 20.9 | 35.7 | 31.0 |
| 100oC | 175 | 246 | 39.1 | 56.6 |
①操作III中采用减压过滤,装置如右图所示,仪器A和B的名称分别是
,
②该装置有三处错误,分别是
,
③若实验过程中发现倒吸现象,应采取的措施是 。
(4) KNO3晶体纯品的产率 。 