题目内容
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)  4NO2 (g)+ O2(g) ΔH > 0 T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2 (g)+ O2(g) ΔH > 0 T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是 ( )
A.500 s内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
C
解析试题分析:A、500 s内N2O5的浓度变化量为5.00 mol·L-1-3.52 mol·L-1="1.48" mol·L-1,v="1.48" mol·L-1÷1.48 mol·L-1="0.00296" mol·L-1·S-1,即2.96╳10-3mol·L-1·s-1,正确;B项分析如下:
2N2O5(g)  4NO2 (g)+ O2(g)
4NO2 (g)+ O2(g)
起始浓度(mol/L) 5.00 0 0
转化浓度(mol/L) 2.50 5.00 1.25
平衡浓度(mol/L) 2.50 5.00 1.25
K=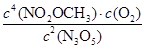 =
= ="125" mol3L-3,平衡时,平衡时N2O5的转化率为50%,正确;C、因为该反应正反应方向为吸热反应,若T1>T2,由T1→T2,相当于是降低温度,降低温度,平衡向逆反应方向进行,平衡常数K2减小,应为K1>K2,错误;D、达平衡后其他条件不变,将容器的体积压缩到原来的1/2,相当于增加压强,增大压强,平衡左移,则c(N2O5)> 5.00 mol·L-1,正确。
="125" mol3L-3,平衡时,平衡时N2O5的转化率为50%,正确;C、因为该反应正反应方向为吸热反应,若T1>T2,由T1→T2,相当于是降低温度,降低温度,平衡向逆反应方向进行,平衡常数K2减小,应为K1>K2,错误;D、达平衡后其他条件不变,将容器的体积压缩到原来的1/2,相当于增加压强,增大压强,平衡左移,则c(N2O5)> 5.00 mol·L-1,正确。
考点、考查化学反应速率和化学平衡的移动、化学平衡常数的计算。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案对于可逆反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,降低温度产生的影响为
2SO3(g) ΔH<0,降低温度产生的影响为
| A.v正 增大,v逆减小 | B.v正减小,v逆增大 |
| C.v正和v逆同程度的减小 | D.v正和v逆不同等程度的减小 |
下列事实不能用平衡移动原理解释的是
 |      |  |  |
| A | B | C | D |
在密闭容器中进行如下反应:H2(g)+I2(g) 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示,符合图示的正确判断是
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示,符合图示的正确判断是
| A.T1>T2,△H>0 | B.T1> T2,△H<0 |
| C.T1<T2,△H>0 | D.T1< T2,△H<0 |
在密闭容器中进行反应M(g)+N(g)  Y(g)+2Z(?),产物Y在平衡混合物中的质量分数(Y%)不同温度、压强条件下随时间的变化如图所示,则下列叙述正确的是
Y(g)+2Z(?),产物Y在平衡混合物中的质量分数(Y%)不同温度、压强条件下随时间的变化如图所示,则下列叙述正确的是
| A.正反应为放热反应,Z是气体 |
| B.正反应为放热反应,Z是固体或液体 |
| C.正反应为吸热反应,Z是气体 |
| D.正反应为吸热反应,Z是固体或液体 |
一定条件下进行反应:COCl2(g) Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入
1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是
A.保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol·L-1,则反应的ΔH<0
B.若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆)
D.保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60%
下列事实,不能用勒夏特列原理解释的是
| A.硫酸工业中,增大O2的浓度有利于提高SO2的转化率 |
B.对2HI H2+I2平衡体系增加压强使颜色变深 H2+I2平衡体系增加压强使颜色变深 |
| C.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| D.滴有酚酞的氨水溶液,适当加热溶液(氨气不挥发)后颜色变深 |
在我国汽车尾气已成为主要的大气污染物,使用稀土等催化剂能将汽车尾气中的CO、NOx和碳氢化合物转化成无毒物质,从而减少污染。向容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入等量的NOx及C3H6,在不同温度下,发生如下反应:
①18 NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g);
②18 NO2(g)+4C3H6(g) 9N2(g)+12 CO2(g)+12 H2O(g)
9N2(g)+12 CO2(g)+12 H2O(g)
分别测定不同温度时NOx的转化率,所得的曲线如图所示。下列说法正确的是( )。
| A.该反应的ΔH>0 |
| B.加入催化剂,NO(g)的转化率比NO2(g)的低 |
| C.分离出H2O(g)可提高碳氢化合物的转化率 |
| D.增大C3H6(g)的浓度可提高NOx的转化率,具有实际意义 |
 2A(g) + 3B2(g) △H >0 ,下列图像不正确的是
2A(g) + 3B2(g) △H >0 ,下列图像不正确的是