题目内容
【题目】【2017宝山区二模】氮的单质及其化合物性质多样,用途广泛.
完成下列填空.
(1)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO![]() 2CO2+N2+Q(Q>0)
2CO2+N2+Q(Q>0)
某温度下测得该反应在不同时间的CO浓度如表:
时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60×10﹣3 | 3.05×10﹣3 | 2.85×10﹣3 | 2.75×10﹣3 | 2.70×10﹣3 | 2.70×10﹣3 |
该反应平衡常数K的表达式为 ;温度升高,K值 (选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)= ;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是 .
(2)工业合成氨的反应温度选择500℃左右的原因是 .
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是 .
a.N2、H2、NH3的浓度之比为1:3:2
b.容器内的压强保持不变
c.N2、H2、NH3的浓度不再发生变化
d.反应停止,正、逆反应的速率都等于零
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是 ;在通入NH3的过程中溶液的导电能力 (选填“变大”、“变小”、“几乎不变”)。
【答案】(1)  减小 1.875×10﹣4mol/(Ls) 增大压强 (2)催化剂在500℃左右具有最佳活性 (3)bc (4)c(Cl﹣)>(NH4+)>c(H+)>c(OH﹣);几乎不变
减小 1.875×10﹣4mol/(Ls) 增大压强 (2)催化剂在500℃左右具有最佳活性 (3)bc (4)c(Cl﹣)>(NH4+)>c(H+)>c(OH﹣);几乎不变
【解析】(1)根据平衡常数等于生成物浓度的系数次幂之积除以反应浓度系数次幂之积,所以K=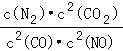 ,该反应为放热反应,温度时平衡逆向移动,所以平衡常数减小,v(CO)=
,该反应为放热反应,温度时平衡逆向移动,所以平衡常数减小,v(CO)=![]() =
=![]() =3.75×10﹣4mol/l,v(N2)=
=3.75×10﹣4mol/l,v(N2)=![]() =1.875×10﹣4mol/(Ls);一氧化氮的转化率变大,说明平衡正向移动可以通过改变压强,使平衡正向移动;
=1.875×10﹣4mol/(Ls);一氧化氮的转化率变大,说明平衡正向移动可以通过改变压强,使平衡正向移动;
(2)工业合成氨的反应是可逆的,选择500℃左右的较高温度能使反应逆向进行,不利于化学平衡的正向移动,使用该温度主要是考虑催化剂的催化效率以及反应速率等知识;
(3)a.N2、H2、NH3的浓度之比为1:3:2,并不是不变,故错误;b.容器内的压强保持不变,说明气体的物质的量不变,反应达平衡状态,故正确;c.N2、H2、NH3的浓度不再发生变化,说明正逆反应速率相等,反应达平衡状态,故正确;d.化学平衡状态是动态平衡,反应不可能停止,故错误;故选bc;
(4)二者恰好反应生成氯化铵,溶液呈酸性,即c(H+)>c(OH﹣),依据溶液呈电中性有:c(H+)+c(NH4+)=c(OH﹣)+c(Cl﹣),因为c(H+)>c(OH﹣),∴c(NH4+)<c(Cl﹣),故离子浓度大小关系为:c(Cl﹣)>(NH4+)>c(H+)>c(OH﹣),溶液中离子浓度几乎不变,所以导电能力几乎不变。

 阅读快车系列答案
阅读快车系列答案【题目】【2017硚口区校级模拟】某兴趣小组为探究外界条件对可逆反应A(g)+B(g)═C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ.然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ.
A | B | C | |
Ⅰ | 0.050molL﹣1 | 0.050molL﹣1 | 0.050molL﹣1 |
Ⅱ | 0.070molL﹣1 | 0.070molL﹣1 | 0.098molL﹣1 |
Ⅲ | 0.060molL﹣1 | 0.060molL﹣1 | 0.040molL﹣1 |
Ⅳ | 0.080molL﹣1 | 0.080molL﹣1 | 0.12molL﹣1 |
针对上述系列实验,下列结论中错误的是( )
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20mol﹣1L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,只能通过压缩容器的体积才可以实现