题目内容
【题目】下列关于氮及其化合物的说法错误的是( )
A. N2化学性质稳定,是因为分子内氮氮键很强
B. NO、NO2均为大气污染气体,在大气中可稳定存在
C. 可用浓盐酸检测输送NH3的管道是否发生泄漏
D. HNO3具有强氧化性,可溶解铜、银等不活泼金属
【答案】B
【解析】
A. N2分子中存在氮氮三键,化学性质比较稳定,故A正确;
B. NO、NO2均为大气污染气体,其中NO遇氧气可以与之反应生成NO2,故B错误;
C. 浓盐酸易挥发,与氨气反应生成氯化铵,可以看到白烟,可用浓盐酸检测输送NH3的管道是否发生泄漏,故C正确;
D. HNO3具有强氧化性,可以与铜和银反应,所以可溶解铜、银等不活泼金属,故D正确,
故选B。

 名校课堂系列答案
名校课堂系列答案【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
(1)Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间:
序号 | 反应 | c(H2O2)/ | V(H2O2) | m(MnO2) | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
a.设计实验2和实验3的目的是研究对化学反应速率的影响;
b.为研究温度对化学反应速率的影响,可以将实验和实验作对比(填序号);
c.将实验1和实验2作对比,t1t2(填“>”、“<”或“=”).
(2)Ⅱ.以KI和FeCl3反应为例(2Fe3++2I﹣2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1molL﹣1KI溶液②0.1molL﹣1 FeCl3溶液③0.1molL﹣1 FeCl2溶液
④0.1molL﹣1盐酸⑤0.1molL﹣1KSCN溶液⑥CCl4
实验步骤:
a.取5mL 0.1molL﹣1 KI溶液,再滴加几滴0.1molL﹣1 FeCl3溶液;
b.充分反应后,将溶液分成三份;
c.取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
d.另取一份,加试剂(填序号),现象,说明此反应存在一定的限度.
(3)Ⅲ.N2O4可分解为NO2 . 在100mL密闭容器中投入0.01mol N2O4 , 利用现代化学实验技术跟踪测量c(NO2).c(NO2)随时间变化的数据记录如图所示: 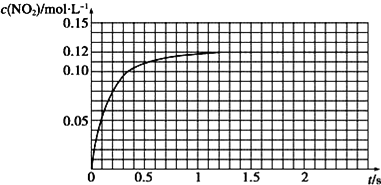
a.反应容器中最后剩余的物质有 , 其中N2O4的物质的量为mol;
b.c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后 . (选填“变大”,“变小”或“不变”)
【题目】实验室制备硝基苯的反应原理和实验装置如下: ![]()
存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯,有关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
实验步骤如下:
取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混合液,将混合酸小心加入B中,把17.73mL(15.6g)苯加入A中.向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束.
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤.分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2 , 进行蒸馏纯化,收集205~210℃馏分,得到纯硝酸基苯18.45g.回答下列问题: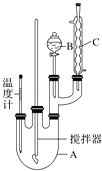
(1)装置B的名称是 , 装置C的作用是;
(2)配制混合液时,(填“能”或“不能”)将浓硝酸加入到浓硫酸中,说明理由:;
(3)为了使反应在50~60℃下进行,常用的方法是;
(4)在洗涤操作中,第二次水洗的作用是;
(5)本实验所得到的硝基苯产率是(保留两位有效数字).
【题目】【2017宝山区二模】氮的单质及其化合物性质多样,用途广泛.
完成下列填空.
(1)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO![]() 2CO2+N2+Q(Q>0)
2CO2+N2+Q(Q>0)
某温度下测得该反应在不同时间的CO浓度如表:
时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60×10﹣3 | 3.05×10﹣3 | 2.85×10﹣3 | 2.75×10﹣3 | 2.70×10﹣3 | 2.70×10﹣3 |
该反应平衡常数K的表达式为 ;温度升高,K值 (选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)= ;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是 .
(2)工业合成氨的反应温度选择500℃左右的原因是 .
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是 .
a.N2、H2、NH3的浓度之比为1:3:2
b.容器内的压强保持不变
c.N2、H2、NH3的浓度不再发生变化
d.反应停止,正、逆反应的速率都等于零
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是 ;在通入NH3的过程中溶液的导电能力 (选填“变大”、“变小”、“几乎不变”)。