题目内容
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图
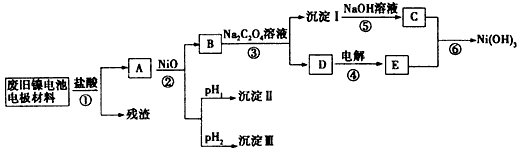
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
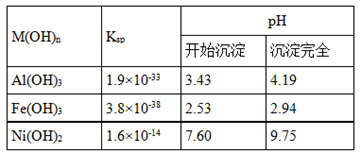
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ 和沉淀Ⅲ (填化学式),则pH1 pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用 。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,则反应③的化学方程式是 。第③步反应后,过滤沉淀时需要的玻璃仪器有 。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因 、 。
(3)④中阳极反应产生的气体E为 ,验证该气体的试剂为 。
(4)试写出反应⑥的离子方程式 。

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:

回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ 和沉淀Ⅲ (填化学式),则pH1 pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用 。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,则反应③的化学方程式是 。第③步反应后,过滤沉淀时需要的玻璃仪器有 。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因 、 。
(3)④中阳极反应产生的气体E为 ,验证该气体的试剂为 。
(4)试写出反应⑥的离子方程式 。
(1)Fe(OH)3 Al(OH)3 < C
(2)NiCl2+Na2C2O4+2H2O=NiC2O4·2H2O+2NaCl ;烧杯、漏斗、玻璃棒;滤纸破损、过滤液的液面高于滤纸的边缘
(3)Cl2;湿润的淀粉碘化钾试纸
(4)2Ni(OH)2+Cl2+2OH—=2Ni(OH)3+2Cl—
(2)NiCl2+Na2C2O4+2H2O=NiC2O4·2H2O+2NaCl ;烧杯、漏斗、玻璃棒;滤纸破损、过滤液的液面高于滤纸的边缘
(3)Cl2;湿润的淀粉碘化钾试纸
(4)2Ni(OH)2+Cl2+2OH—=2Ni(OH)3+2Cl—
由题给条件,金属氢氧化物的Ksp及沉淀析出的理论pH,可知,在A溶液中加入NiO是为了调节溶液pH,使相应的铝离子、三价铁离子全部沉淀出,Ni2+在溶液B中.根据pH可以确定开始析出沉淀和全部沉淀的pH范围,先析出沉淀Ⅱ是Fe(OH)3,沉淀pH范围是2.53~2.94,然后析出沉淀Ⅲ是Al(OH)3,沉淀PH的范围3.43~4.19,所以pH1<pH2;控制两种沉淀析出必须准确测定pH值,所以应利用pH计测定。
(2)由溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,结合流程中的变化
可知沉淀为溶解度小的NiC2O4?2H2O,所以根据转化关系写出化学方程式;
在过滤装置中用到的玻璃仪器和注意问题,根据装置和操作步骤写出NiCl2+Na2C2O4+2H2O=NiC2O4·2H2O+2NaCl,漏斗,烧杯、玻璃棒;滤纸破损、过滤液的液面高于滤纸的边缘。
(3)由流程图和以上分析可知,D溶液主要是氯化钠溶液,电解氯化钠溶液在阳极得到氯气,阴极得到氢气,所以E气体是Clc 2,验证氯气的试剂应是淀粉碘化钾溶液,遇氯气变蓝;
(4)在B溶液中加入Na2C2O4溶液生成了沉淀ⅠNiC2O4.2H2O,沉淀中加入氢氧化钠溶液,根据Ni(OH)2开始沉淀到全部沉淀的pH范围为7.60~9.75,加入过量氢氧化钠溶液能使沉淀NiC2O4·2H2O转化为Ni(OH)2,所以C为沉淀Ni(OH)2;根据流程图中的转化关系,沉淀C和氯气能生成Ni(OH)3,镍元素化合价升高是被氯气氧化的结果,因此离子方程式为2Ni(OH)2+2OH-+Cl2=2Ni(OH)3+2Cl-
(2)由溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,结合流程中的变化
可知沉淀为溶解度小的NiC2O4?2H2O,所以根据转化关系写出化学方程式;
在过滤装置中用到的玻璃仪器和注意问题,根据装置和操作步骤写出NiCl2+Na2C2O4+2H2O=NiC2O4·2H2O+2NaCl,漏斗,烧杯、玻璃棒;滤纸破损、过滤液的液面高于滤纸的边缘。
(3)由流程图和以上分析可知,D溶液主要是氯化钠溶液,电解氯化钠溶液在阳极得到氯气,阴极得到氢气,所以E气体是Clc 2,验证氯气的试剂应是淀粉碘化钾溶液,遇氯气变蓝;
(4)在B溶液中加入Na2C2O4溶液生成了沉淀ⅠNiC2O4.2H2O,沉淀中加入氢氧化钠溶液,根据Ni(OH)2开始沉淀到全部沉淀的pH范围为7.60~9.75,加入过量氢氧化钠溶液能使沉淀NiC2O4·2H2O转化为Ni(OH)2,所以C为沉淀Ni(OH)2;根据流程图中的转化关系,沉淀C和氯气能生成Ni(OH)3,镍元素化合价升高是被氯气氧化的结果,因此离子方程式为2Ni(OH)2+2OH-+Cl2=2Ni(OH)3+2Cl-

练习册系列答案
相关题目
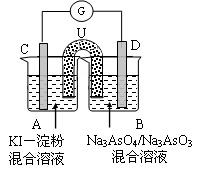

 AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为
AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为 
 Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0
