题目内容
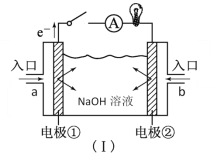
【题目】(1)如图装置(Ⅰ)为以NaOH溶液为电解质溶液的氢氧燃料电池。装置(Ⅰ)中a和b为气体进口,其中a口进入的是(填名称)____,写出电极②发生反应的电极反应式______。
(2)将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变)。
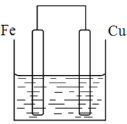
①铁片上的电极反应式为_____。
②溶液中的铜离子移向____(填铁电极或铜电极)。
【答案】氢气 O2+4e-+2H2O=4OH- Fe-2e-=Fe2+ 铜电极
【解析】
根据原电池和燃料电池原理判断正负极,书写相关电极反应式。
(1)燃料电池通燃料的一极为负极,通氧气的一极为正极,a为电子流出的负极,故a通氢气,b为正极,氧气得电子发生还原反应,O2+4e-+2H2O=4OH-,故答案为:氢气;O2+4e-+2H2O=4OH-;
(2)①如图所示,活泼金属铁作为负极,失电子发生氧化反应,铁片上的电极反应式为Fe-2e-=Fe2+;
②溶液中铜离子得电子,发生还原反应,铜离子在正极得电子,所以溶液中的铜离子移向铜电极。

【题目】卤素及其化合物在生活、生产等领域有广泛应用。
(1)从海带等富含碘的物质中提取碘的工艺步骤之一为:在稀硫酸酸化作用下.用二氧化锰氧化I-,其离子方程式为____,该反应的还原产物为______(填化学式).
(2)从海水中提取溴的过程是:向酸化的海水中通入氯气![]() 富集溴
富集溴![]() 氧化溴
氧化溴![]() 提纯溴。
提纯溴。
已知部分信息(其中a>0,b>0);
Ⅰ.H2(g)+Cl2(g)=2HCl(g)ΔH=-akJ/mol
Ⅱ.H2(g)+Br2(g)=2HBr(g)ΔH2=-bkJ/mol
Ⅲ.几种化学键的键能数据如表所示:
化学键 | H-Br | H-Cl | Cl-Cl | Br-Br |
键能/(KJ/mol) | 366 | 432 | 243 | 194 |
①酸化海水的目的是_______
②比较大小:a_____b(填“>”、“=”或“<”)
③计算2HBr(g)+Cl2(g)=2HCl(g)+Br2(g)ΔH=_____kJ/mol(填具体数值)=_____kJ/mol (填含a,b的代数式)
(3)298K,取一定量的含Br-、Cl-的浓缩溶液。滴加稀硝酸银溶液。当生成浅黄色沉定时存在平衡: AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq),该反应的化学平衡常数为_______已知:[Ksp(AgCl)=1.54×10-10、Ksp(AgBr)=7.7×10-13]。
AgBr(s)+Cl-(aq),该反应的化学平衡常数为_______已知:[Ksp(AgCl)=1.54×10-10、Ksp(AgBr)=7.7×10-13]。
(4)常温下Fe3+和I-在水中的反应为2Fe3+(aq)+2I-(aq)![]() 2Fe2+(aq)+I2(aq)(不考虑离子水解)。下列情况能说明该反应达到平衡状态的是_____(填字母)
2Fe2+(aq)+I2(aq)(不考虑离子水解)。下列情况能说明该反应达到平衡状态的是_____(填字母)
A.Fe3+的消耗速率率等于Fe2+的生成速率
B.溶液的颜色保持不再变化
C.2v(I-)逆=v(I2)正
D.溶液中的c(Fe3+)=c(I-)
E.溶液中的![]() 保持不再变化
保持不再变化
(5)CuBr2是一种重要的化工原料,在密闭容器中投入足量的CuBr(s),在一定温度下发生反应:2CuBr2(s)![]() 2CuBr(s)+Br2(g)反应达到平衡时,c(Br2)=10mol/L。如果温度保持不变,将容器体积用缩至原来的一。则平衡时c(Br2)的浓度(mol/L)可能为____mol/L (填字母)。
2CuBr(s)+Br2(g)反应达到平衡时,c(Br2)=10mol/L。如果温度保持不变,将容器体积用缩至原来的一。则平衡时c(Br2)的浓度(mol/L)可能为____mol/L (填字母)。
A.0.5 b.1.0 c.3.0 d.4.0
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%