��Ŀ����
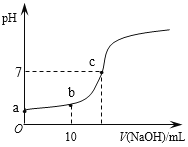
����Ŀ��50 mL 0.50 mol/L������50 mL 0.55 mol/L NaOH��Һ����ͼ��ʾ��װ���н���
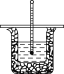
�кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
(1)��ʵ��װ���Ͽ���ͼ��ȱ�ٵ�һ�ֲ�����Ʒ��_____________��
(2)ʵ���и���60 mL 0.50 mol/L������60 mL 0.55 mol/L NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������____(��������������������)������õ��к���____(��������������������)���������ɣ�___________________________________________��
(3)ʵ���и���6.94 mL 15 mol/L������Һ��60 mL 0.55 mol/L NaOH��Һ���з�Ӧ��������ʵ����ȣ������к���________(��������������������)���������ɣ�_____________________________________________________________________
(4)������ƽ�в��������������ʼʱ�������ռ���Һƽ���¶���ͬ������ֹ�¶�����ʼ�¶Ȳ�(t2��t1)�ֱ�Ϊ��3.3 �桢��3.5 �桢��4.5 �棬�����մ������ʽ���²�ƽ��ֵΪ____�档
(5)��������(4)С��Ľ��ۣ������ʵ���õ��кͷ�Ӧ��Ӧ����H��____[�������NaOH��Һ���ܶ�Ϊ1 g/cm3����Ӧ������Һ�ı�����(c)Ϊ4.18 J/(g����)]��
(6)����NaOH��Һ��Ϊ��ͬ�������ͬŨ�ȵİ�ˮ������кͷ�Ӧ��Ӧ��Ϊ��H1������H1��ԭ������H�Ĺ�ϵΪ��H1____(����<����>����������)��H��������________��
���𰸡����β�������� ����� ��� ��Ϊ�к�����ָϡ��ǿ���ǿ����кͷ�Ӧ����1molH2O���ų��������������������� ����� Ũ����ϡ��ʱ��ų����� 3.4�� 56.8kJ/mol ��H1����H һˮ�ϰ�Ϊ����������Ϊ���ȹ��̣������ð�ˮ����ϡ����������Һ��Ӧ����Ӧ�ų�������С��56.8kJ
��������
��1���������ȼƵĹ������жϸ�װ�õ�ȱ��������
��2���ı�������������ų���������仯�����к����Dz���ģ�����к��ȵĸ����ʵ�����ش�
��3������Ũ����ϡ�ͷų�����������
��4�����ij������ֵ������ֵ���ϴ��������ȡ�ø�ֵ�IJ����д��ڽ����ص�ʧ��Ӧ��ȥ��
��1�������ȼƵĹ����֪��װ�õ�ȱ�������ǻ��β����������
�ʴ�Ϊ�����β��������
��2������60mL 0.50mol/L������60mL 0.55mol/L NaOH��Һ���з�Ӧ������ˮ�������࣬���ų�������ƫ�ߣ������к�����ǿ���ǿ�Ӧ����1molˮʱ�ų����ȣ������к�����ȣ�
�ʴ�Ϊ������ȣ���ȣ���Ϊ�к�����ָϡ��ǿ���ǿ����кͷ�Ӧ����1mol H2O���ų��������������������أ�
��3��15mol/L��������Ũ���ᣬŨ����ϡ�ͻ�ų������������루4����ȣ������к��Ȳ���ȣ�
�ʴ�Ϊ������ȣ�Ũ����ϡ��ʱ��ų�������
��4���������ݿ�֪��ʵ��۵�������ȥ�������¶Ȳ��ƽ��ֵ��(3.3�棫3.5��)��2��3.4�档
�ʴ�Ϊ3.4��
��5��50mL 0.50mol/L ���ᡢ50mL 0.55mol /L NaOH��������Ϊm=100mL��1g/mL=100g��c=4.18J/(g��)��T2-T1=3.4�棬���빫ʽQ=cm��T������0.025mol��ˮ�ų�����Q=4.18J/(g��)��100g��3.4��=1421.2J=1.4212kJ��������0.025mol��ˮ�ų�����Ϊ1.4212kJ����������1mol��ˮ�ų�����Ϊ56.8kJ������ʵ���õ��к��ȡ�H=-56.8kJ/mol��
�ʴ�Ϊ��56.8kJ/mol��
��6��һˮ�ϰ�Ϊ����������Ϊ���ȹ��̣������ð�ˮ����ϡ����������Һ��Ӧ����Ӧ�ų�������С��56.8kJ��������H1����H��
�ʴ�Ϊ����H1����H��һˮ�ϰ�Ϊ����������Ϊ���ȹ��̣������ð�ˮ����ϡ����������Һ��Ӧ����Ӧ�ų�������С��56.8kJ��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��25��ʱ�������ܵ���ʵ��ܽ�������ʾ��
���ܵ���� | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
�ܽ��/g | 9��10-4 | 1.7��10-6 | 1.5��10-4 | 3.0��10-9 |
������ȫʱ��pH | 11.1 | 6.7 | 9.6 | 3.7 |
������������ᴿ�У����������ܵ���ʵ��ܽ�ƽ��ԭ����ȥijЩ���ӡ����磺
��Ϊ�˳�ȥ�Ȼ���е�����Fe3�����Ƚ����������ˮ���ټ���һ�������Լ���Ӧ�����˽ᾧ���ɣ�
��Ϊ�˳�ȥ�Ȼ�þ�����е�����Fe3�����Ƚ����������ˮ������������������þ����ַ�Ӧ�����˽ᾧ���ɣ�
��Ϊ�˳�ȥ����ͭ�����е�����Fe2�����Ƚ����������ˮ������һ������H2O2����Fe2��������Fe3����������Һ��pH=4�����˽ᾧ���ɡ���ش��������⣺
��1�������������ӷ������ܹ��ﵽ�ܺ�Ч����Fe2����Fe3������ת��Ϊ__(�ѧʽ)����ȥ��
��2�����м�����Լ�Ӧ��ѡ��__����ԭ����__��
��3�����г�ȥFe3�������������ӷ���ʽΪ___��
��4�������뷽������ص������У���ȷ����___(����ĸ)��
A��H2O2����ɫ�������������������в��������ʣ���������Ⱦ
B����Fe2������ΪFe3������Ҫԭ����Fe(OH)2������Fe(OH)3�����ѹ���
C��������ҺpH��4��ѡ����Լ���������ͭ���ʽ̼��ͭ
D��Cu2�����Դ���������pH��4����Һ��
E����pH>4����Һ��Fe3��һ�����ܴ�������
����Ŀ��ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺
��ʵ��ԭ����2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2��+8H2O
��ʵ�����ݼ���¼��
ʵ���� | ʵ���¶� | �Թ��������Լ���������/mL | ��Һ������ɫ����ʱ��/min | |||
0.6mol/L H2C2O4��Һ | H2O | 3mol/L ϡH2SO4��Һ | 0.05mol/L KMnO4��Һ | |||
�� | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
�� | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
�� | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)����ɴ�ʵ����ƣ����У�V1=_________��V2=___________��
(2)�����ϱ���ʵ��١��ڵ����ݣ����Եõ��Ľ�����_________________________________��
(3)̽���¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬Ӧѡ��__________����ʵ���ţ���
(4)��С��ͬѧ���ݾ��������n(Mn2+)��ʱ��仯��������ͼ1��ʾ������ͬѧ�������е�ʵ�����Ϸ��֣���ʵ�������n(Mn2+)��ʱ��仯��ʵ��������ͼ2��ʾ��

��С��ͬѧ����ͼ2��ʾ��Ϣ������µļ��裬���������ʵ�鷽����������ʵ��̽����
ʵ���� | ʵ���¶�/�� | �Թ��������Լ��������� | �����Թ��м���ij�ֹ��� | ��Һ������ɫ����ʱ��/min | |||
0.6mol/L H2C2O4��Һ | H2O | 3mol/L ϡH2SO4��Һ | 0.05mol/L KMnO4��Һ | ||||
�� | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
��С��ͬѧ����ļ�����___________________________________________��