题目内容
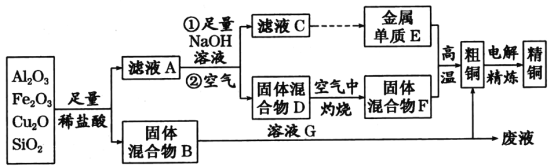
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验。下列有关说法正确的是:

A. 根据上述步骤II可以得出m(Fe2O3)∶m(Cu)=1∶1
B. 步骤I中减少的3 g固体一定是混合物
C. 步骤II中质量减少的物质一定是Cu
D. 根据步骤I、II可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
【答案】A
【解析】
9.4gX与过量的氢氧化钠溶液反应后得到6.4g不溶物,固体部分溶解,原固体中至少含有Al2O3、SiO2的一种物质;6.4g固体与过量的盐酸反应得到蓝色溶液,蓝色溶液中存在铜离子,发生了反应:Fe2O3+6H+═2Fe3++3H2O;Cu+2Fe3+═2Fe2++Cu2+,说明溶液中一定存在Fe2O3,1.92g固体为铜。
A、设氧化铁的物质的量是x,金属铜的物质的量是y,由Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=2Fe2++Cu2+得出:Fe2O3~2Fe3+~Cu,则160x+64y=6.4,64y-64x=1.92,解得x=0.02mol,y=0.05mol,所以氧化铁的质量为0.02mol×160g·mol-1=3.2g,金属铜的质量为0.05mol×64g·mol-1=3.2g,则原混合物中m(Fe2O3):m(Cu)=1:1,故A正确。
B、步骤Ⅰ中,加入过量氢氧化钠溶液固体质量减少了3 g,溶解的物质可能是Al2O3和SiO2中的一种或两种,故B错误;
C、步骤Ⅱ中加入过量盐酸,Fe2O3溶解后又和Cu发生反应,故减少的固体是Fe2O3和Cu,故C错误;
D、根据步骤I只能判断混合物中至少含有Al2O3、SiO2的一种物质,无法确定Al2O3、SiO2是否都存在;步骤II可以确定一定存在Fe2O3、Cu,故D错误;
故选A。