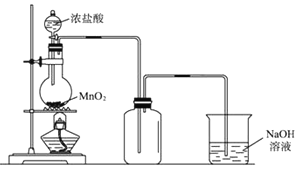
题目内容
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
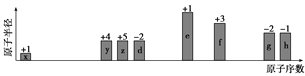
根据判断出的元素及相应化学式回答问题:
(1)f在周期表中的位置是________________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):____________;比较g、h的最高价氧化物对应水化物的酸性强弱:______________。
(3)y形成的最简单气态氢化物的空间构型__________。
【答案】 第3周期第ⅢA族 r(O2-) >r(Na+) HClO4>H2SO4 正四面体
【解析】从图中的化合价、原子半径的大小及原子序数可知:x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,(1)f是Al元素,其原子序数为13,在元素周期表中位于第三周期ⅢA族;电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(O2-) >r(Na+) ;非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4;(3)y形成的最简单气态氢化物CH4的空间构型正四面体。

练习册系列答案
相关题目