题目内容
【题目】实验室中常用氧化浓盐酸的方法制取氯气,实验装置如图所示:
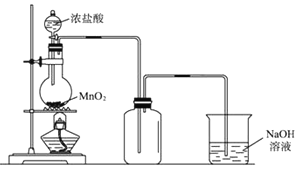
(1)写出制备氯气的离子方程式: ______ ;
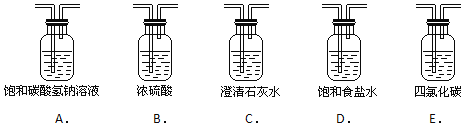
(2)为了得到纯净、干燥的氯气,此装置还需增加净化装置,请根据气体的流动方向,依次按顺序选择所用的装置,正确的选项是 ______ ;
(3)如果将过量二氧化锰与20mL12mol/L的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,其主要原因有:① ______ ;② ______ .
(4)多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置 ______ ;
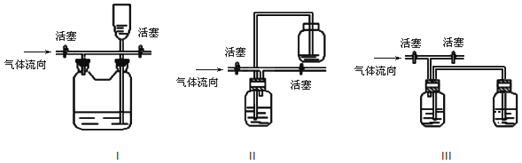
【答案】 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O DB 浓盐酸挥发 浓盐酸反应后浓度下降而与MnO2不反应 I,II
Mn2++Cl2↑+2H2O DB 浓盐酸挥发 浓盐酸反应后浓度下降而与MnO2不反应 I,II
【解析】(1)写出制备氯气的离子方程式:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;(2)浓盐酸易挥发,制备的氯气中含有氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,浓硫酸具有吸水性依次通过饱和食盐水、浓硫酸除去氯化氢和水蒸气;故选:DB;(3)二氧化锰只与浓盐酸反应,反应过程中消耗氯化氢,同时浓盐酸易挥发,导致盐酸浓度降低变为稀盐酸,不再与二氧化锰反应;(4)氯气在饱和食盐水中溶解度不大,用排饱和食盐水法可以存贮氯气,所以装置I,II都可以用来多余的氯气。
Mn2++Cl2↑+2H2O;(2)浓盐酸易挥发,制备的氯气中含有氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,浓硫酸具有吸水性依次通过饱和食盐水、浓硫酸除去氯化氢和水蒸气;故选:DB;(3)二氧化锰只与浓盐酸反应,反应过程中消耗氯化氢,同时浓盐酸易挥发,导致盐酸浓度降低变为稀盐酸,不再与二氧化锰反应;(4)氯气在饱和食盐水中溶解度不大,用排饱和食盐水法可以存贮氯气,所以装置I,II都可以用来多余的氯气。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
【题目】下列关于化合物,单质,混合物,电解质和非电解质的正确组合是( )
化合物 | 单质 | 混合物 | 电解质 | 非电解质 | |
A | 烧碱 | 液态氧 | 冰水混合物 | 醋酸 | 三氧化硫 |
B | 生石灰 | 白磷 | 胆矾 | 氧化铝 | 氯气 |
C | 干冰 | 铁 | 氨水 | 石灰石 | 酒精 |
D | 空气 | 氮气 | 小苏打 | 氯化铜 | 硫酸钡 |
A. A B. B C. C D. D