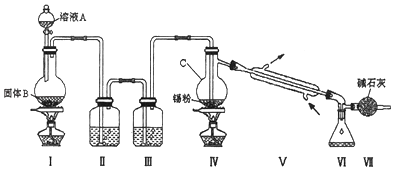
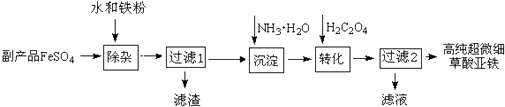
题目内容
【题目】已知在298K时下述反应的有关数据:
C(s)+ ![]() O2(g)=CO(g)△H1=﹣110.5kJ/mol
O2(g)=CO(g)△H1=﹣110.5kJ/mol
C(s)+O2(g)=CO2(g),△H2=﹣393.5kJ/mol
则C(s)+CO2(g)=2CO(g)的△H 为( )
A.283.5kJ/mol
B.172.5kJ/mol
C.﹣172.5kJ/mol
D.﹣504 kJ/mol
【答案】B
【解析】解:已知:C (s)+ ![]() O2(g)=CO(g)△H=﹣110.50KJ/mol ① C (s)+O2(g)=CO2(g)△H=﹣393.51KJ/mol ②
O2(g)=CO(g)△H=﹣110.50KJ/mol ① C (s)+O2(g)=CO2(g)△H=﹣393.51KJ/mol ②
根据盖斯定律,将①×2﹣②可得:C (s)+CO2(g)=2CO(g)△H=(﹣110.50KJ/mol)×2﹣(﹣393.51KJ/mol)=+172.5KJ/mol,
故选B.
根据盖斯定律﹣﹣化学反应不管是一步完成还是分几步完成,其反应热是相同的,将反应①﹣②即可得目标反应,将反应热做相应变化即可.

练习册系列答案
相关题目