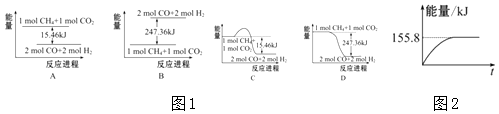
题目内容
【题目】周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中的未成对电子有3个,C的s能级电子总数与p能级电子总数相等,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题:
(1)E+离子的基态核外电子排布
(2)B、C、D中第一电离能由大到小的顺序为(填元素符号)
(3)A和B、C两元素形成的两种共价化合物发生反应,生成BA4+离子,该离子的中心原子的杂化方式为;与BA4+离子互为等电子体的一种分子为(填化学式).
(4)E的硫酸盐溶液中滴加过量的氨水可以生成配合物[E(NH3)4]SO4 , 1mol配合物中含有的σ键的数目为 .
(5)E和C(空心小球为C,实心小球为E)形成的一种离子化合物的晶体结构如图所示,则离子化合物的化学式为 . 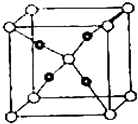
【答案】
(1)1s22s22p63s23p63d10
(2)N>O>S
(3)sp3;CH4
(4)20NA
(5)Cu2O
【解析】解:周期表前四周期的元素A、B、C、D、E,原子序数依次增大,A的核外电子总数与其周期数相同,则A为H元素,C的s能级电子总数与p能级电子总数相等,A和B、C两元素可以形成两种共价化合物,则C为O元素,D与C同族,则D为S元素;B的价电子层中的未成对电子有3个,则B为第ⅤA族元素,B的原子序数小于C,所以B为N元素,E的最外层只有1个电子,但次外层有18个电子,则E为29号Cu元素,(1)Cu+离子核外有28个电子,其基态核外电子排布为1s22s22p63s23p63d10 , 所以答案是:1s22s22p63s23p63d10;(2)B、C、D分别是N、O、S元素中,元素的非金属性越强,其第一电离能越大,同一周期元素中,第一电离能随着原子序数的增大呈增大趋势,但第VA族元素大于相邻元素,所以N、O、S中第一电离能由大到小的顺序为N>O>S,所以答案是:N>O>S;(3)A和B、C两元素形成的两种共价化合物发生反应,生成NH4+离子,该离子的中心原子氮原子的价层电子对数为 ![]() =4,所以氮原子的杂化方式为sp3杂化,与NH4+离子互为等电子体的一种分子为CH4 , 所以答案是:sp3;CH4;(4)在配合物[Cu(NH3)4]SO4中,铜离子与氨分子之间有4个σ键,每个氨分子内部有3个σ键,硫酸根离子中有4个σ键,所以1mol配合物中含有的σ键的数目为(4+4×3+4)NA 个=20NA个,所以答案是:20NA;(5)E和C形成的一种离子化合物的晶体结构如图1,c离子个数=1+8×
=4,所以氮原子的杂化方式为sp3杂化,与NH4+离子互为等电子体的一种分子为CH4 , 所以答案是:sp3;CH4;(4)在配合物[Cu(NH3)4]SO4中,铜离子与氨分子之间有4个σ键,每个氨分子内部有3个σ键,硫酸根离子中有4个σ键,所以1mol配合物中含有的σ键的数目为(4+4×3+4)NA 个=20NA个,所以答案是:20NA;(5)E和C形成的一种离子化合物的晶体结构如图1,c离子个数=1+8× ![]() =2,e离子个数=4,所以该化合物为Cu2O,所以答案是:Cu2O.
=2,e离子个数=4,所以该化合物为Cu2O,所以答案是:Cu2O.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】补充完成下表:
元素 | 甲 | 乙 | 丙 |
元素符号 | ① | ② | O |
原子结构 |
| ③ | ④ |
周期 | 三 | 三 | ⑤ |
族 | ⑥ | ⅦA | ⑦ |
(1)请把序号①一⑦的答案对应填上) ①②③④⑤⑥⑦
(2)甲元素最高价氧化物对应的水化物呈性(填“酸、碱”),乙元素的最高价氧化物对应的水化物的化学式为 .
(3)甲与乙两元素的单质反应生成物的电子式为 , 属于(离子或共价)化合物.
(4)甲单质与丙的氢化物反应的化学方程式为