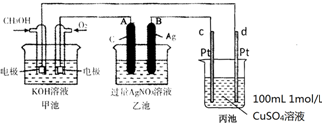
题目内容
17.铬具有抗腐蚀性,在钢中添加适量的铬会得到不锈钢,铬及其化合物在医药和工业中有很多用途,但铬也是造成重金属污染的元素这一.如图是由铬铁矿(铬铁矿的主要成分可表示为FeO•Cr2O3,还含有SiO2、Al2O3等杂质)为原料制取重铬酸钾的流程图(已知高价铬有强氧化性):
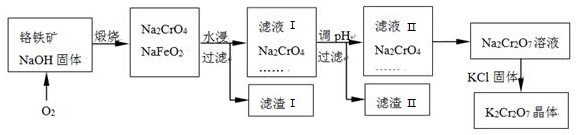
①Na2FeO4中Fe的化合价为+6,
②已知调节pH的过程中有氧气生成,滤渣Ⅱ中含有Fe(OH)3,则Fe(OH)3与氧气物质的量之比为4:7,滤渣Ⅱ中还含有铝硅的化合物,则调节PH的试剂可能是a.
a.CO2 b.盐酸 c.SO2.
分析 由流程可知,煅烧发生4 FeO•Cr2O3+7O2+20NaOH$\frac{\underline{\;煅烧\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O,然后NaFeO2和水反应会产生红褐色沉淀,发生NaFeO2+2H2O=NaOH+Fe(OH)3↓,生成的氢氧化钠和氧化铝反应生成偏铝酸钠,和二氧化硅反应生成硅酸钠,滤液I的成分除Na2CrO4外,还含有偏铝酸钠和硅酸钠,Cr2O72-+H2O  2CrO42-+2H+,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加酸酸化,向Na2Cr2O7溶液中加入KCl固体,加热时,重铬酸钠的溶解度随温度的升高而增大,但是氯化钾的受温度影响不大,所以获得K2Cr2O7晶体的操作依次是:加热浓缩、冷却结晶、过滤、洗涤、干燥,以此来解答.
2CrO42-+2H+,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加酸酸化,向Na2Cr2O7溶液中加入KCl固体,加热时,重铬酸钠的溶解度随温度的升高而增大,但是氯化钾的受温度影响不大,所以获得K2Cr2O7晶体的操作依次是:加热浓缩、冷却结晶、过滤、洗涤、干燥,以此来解答.
解答 解:①Na2FeO4中,Na为+1价,O为-2价,由化合物中正负化合价的倒数和为0可知,Fe的化合价为+6价,故答案为:+6;
②由4 FeO•Cr2O3+7O2+20NaOH$\frac{\underline{\;煅烧\;}}{\;}$8Na2CrO4+4NaFeO2+10H2、NaFeO2+2H2O=NaOH+Fe(OH)3↓可知,7O2~4Fe(OH)3,则Fe(OH)3与氧气物质的量之比为4:7,滤渣Ⅱ中还含有铝硅的化合物,由Cr2O72-+H2O  2CrO42-+2H+,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加酸酸化,若酸为强酸,能溶解Al的化合物,且二氧化硫具有还原性,则调节PH的试剂可能是CO2,
2CrO42-+2H+,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加酸酸化,若酸为强酸,能溶解Al的化合物,且二氧化硫具有还原性,则调节PH的试剂可能是CO2,
故答案为:4:7;a.
点评 本题以物质的制备流程考查氧化还原反应的计算及混合物分离提纯,综合性较强,侧重分析与应用能力的考查,注意流程中的反应、物质的性质来解答,题目难度中等.

| A. | N2、O2和Cl2分子中既含有σ键,又含有π键 | |
| B. | PCl3分子中,中心原子采取sp3杂化方式 | |
| C. | CS2、H2O、C2H2都是直线型分子 | |
| D. | CH4、C6H6都是只含有极性键的非极性分子 |
| A. | 元素X:原子中M层比L层少2个电子 | |
| B. | 元素Y:二价阳离子的核外电子总数与Ne原子相同 | |
| C. | 元素Z:K、L层电子总数是K、M层电子总数的2倍 | |
| D. | 元素W:该元素的某种氧化物能引起温室效应 |
| A. | F-、O2-、S2- | B. | O、P、S | C. | K+、Ca2+、Li+ | D. | Al3+、Mg2+、Li+ |
①加热试管时,先均匀加热,后局部加热
②用排水法收集气体后,先移出导管后撤酒精灯
③制取气体时,先检验装置气密性后装药品
④点燃可燃性气体如H2、CO等时,先检验气体纯度后点燃
⑤做H2还原CuO实验时,先通H2后加热CuO,反应完毕后,先撤酒精灯待试管冷却后停止通H2
⑥量筒用蒸馏水洗涤后再使用
⑦组装仪器的顺序是先下后上,先左后右.
| A. | ①②③⑤⑦ | B. | ①②④⑤⑥ | C. | ①②③④⑤ | D. | 全部 |
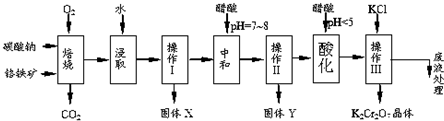
已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑;③Cr2O72-+H2O 2CrO42-+2H+
根据题意回答下列问题:
(1)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(2)酸化步骤用醋酸调节溶液pH<5,其目的是使CrO42-转化为Cr2O72-.
(3)固体X中主要含有Fe2O3、MgO(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用pH计或精密pH试纸(填写仪器或试剂名称).如表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
(4)该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |