题目内容
9.甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料.甲醇在各个领域有着广泛的应用.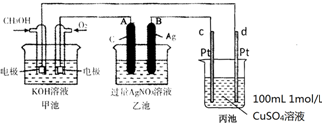
(1)实验测得:32g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出726.4kJ的热量,试写出甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ•mol-1.
(2)燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池.如图是一个化学过程的示意图.2CH3OH+3O2+4KOH$?_{充电}^{放电}$ K2CO3+6H2O
①A(石墨)电极的名称是阳极.
②通入O2的电极的电极反应式是O2+2H2O+4e-=4OH-
③写出通入CH3OH的电极的电极反应式是CH3OH+8OH--6e-=CO32-+6H2O.
④乙池中反应的化学方程式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3.
⑤当电路中通过0.01mol电子时,丙池溶液的C(H+)=0.1mol/L(忽略电解过程中溶液体积的变化).
(3)合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1.
①在恒温恒容条件下,充入一定量的H2和CO,发生反应2H2(g)+CO(g)?CH3OH(g).则该反应达到平衡状态的标志有bcd
a.混合气体的密度保持不变 b.混合气体的总压强保持不变
c.CO的质量分数保持不变 d.甲醇的浓度保持不变
e.v正(H2)=v逆(CH3OH) f.v(CO)=v(CH3OH)
②要提高反应2H2(g)+CO(g)?CH3OH(g)中CO的转化率,可以采取的措施是:df
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2 e.加入惰性气体 f.分离出甲醇.
分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态,根据燃烧热的概念结合热化学方程式的书写来回答;
(2)甲池能自发的进行氧化还原反应,属于原电池,通入甲醇的电极为负极、通入氧气的电极为正极,则乙池、丙池是电解池,A、C属于阳极,B、D属于阴极,A电极反应式为氢氧根离子得电子生成氧气,B极反应式为Ag++e-=Ag、C极反应式为4OH-+4e-=2H2O+O2↑、D极反应式为Cu2++2e-=Cu,据此分析解答;
(3)①平衡状态时正逆反应速率相等,各组分的浓度保持不变;
②要提高CO的转化率,应使平衡向正反应方向移动,结合化学平衡移动原理分析选项.
解答 解:(1)32gCH3OH在氧气中燃烧生成CO2和液态水,放出726.4kJ热量,64g即2molCH3OH在氧气中燃烧生成CO2和液态水,放出1452.8kJ热量,
则燃烧热的热化学方程式为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8 kJ•mol-1,
故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8 kJ•mol-1;
(2)①甲池能自发的进行氧化还原反应,属于燃料电池,为原电池,通入甲醇的电极为负极、通入氧气的电极为正极,乙为电解池,A连接原电池正极,则为阳极,
故答案为:阳极;
②碱性条件下,氧气得电子生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
③碱性条件下,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
④乙池为电解硝酸银溶液的电解池,生成Ag和氧气,电解方程式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3,故答案为:4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3;
⑤丙池中C极反应式为4OH-+4e-=2H2O+O2↑、D极反应式为Cu2++2e-=Cu,当电路中通过0.01mol电子时,有0.01mol氢氧根离子反应,生成0.01mol氢离子,所以c(H+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,故答案为:0.1;
(3)①a.容器体积不变,混合气体的质量不变,所以密度始终不变,混合气体的密度保持不变不能说明反应达到平衡状态,故a错误;
b.该反应前后气体物质的量不同,恒容容器中混合气体的总压强保持不变,说明各组分浓度不变,反应达到平衡状态,故b正确;
c.CO的质量分数保持不变,说明反应达到平衡状态,故c正确;
d.甲醇的浓度保持不变,说明反应达到平衡状态,故d正确;
e.氢气以甲醇的化学计量数不同,v正(H2)=v逆(CH3OH),不能说明正逆反应速率相等,不能说明反应达到平衡状态,故e错误;
f.v(CO)=v(CH3OH),无法判断正逆反应速率相等,故f错误;
故答案为:bcd;
②要提高CO的转化率,应使平衡向正反应方向移动,
a.该反应放热,升温平衡逆向移动,故错误;
b.加入催化剂不影响平衡移动,故错误;
c.增加CO的浓度,CO的转化率降低,故错误;
d.加入H2平衡正向移动,CO的转化率增大,故正确;
e.体积不变加入惰性气体,平衡不移动,故错误;
f.分离出甲醇平衡正向移动,CO的转化率增大,故正确;
故答案为:df.
点评 本题考查了热化学方程式书写、原电池电解池相关知识、化学平衡的移动以及转化率大小的判断,题目综合性强,难度较大.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案| A. | 有较高的熔点 | B. | 熔化时能导电 | C. | 水溶液能导电 | D. | 易溶于水 |
| A. | a=b | B. | a<b | C. | a′>b′ | D. | a′=b′ |
| A. | 16g CH4与18 g NH4+所含质子数相等 | |
| B. | 0.5mol FeCl3滴入沸水可制备胶体粒子0.5 NA | |
| C. | 将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22.4L | |
| D. | 7.8 g Na2O2中含有的离子总数目为0.3NA |
 .
. .
.