题目内容
 某课外活动小组同学用如图装置进行实验,试回答下列问题.
某课外活动小组同学用如图装置进行实验,试回答下列问题.(1)若开始时开关K与a连接,则B极的电极反应式为
Fe-2e-=Fe 2+
Fe-2e-=Fe 2+
.有关该实验,下列说法正确的是(填序号)①③
①③
.①A为正极,B为负极
②电子由电极B流出经溶液流向A极
③溶液中Na+向A极移动
④该反应相当于在模拟钢铁的析氢腐蚀
(2)若开关K与b连接,则可模拟工业上离子交换膜法制烧碱,该电池的总反应可表示为(离子方程式)
2Cl-+2H2O
2OH-+H2↑+Cl2↑
| ||
2Cl-+2H2O
2OH-+H2↑+Cl2↑
.
| ||
有关该实验,下列说法正确的是(填序号)
②④
②④
.①B为阴极,发生氧化反应
②A极电极反应式可表示为2Cl-=Cl2↑+2e-
③溶液中Na+向A极移动
④若标准状况下B极产生2.24L气体,则电路中通过的电子数为0.2NA.
分析:(1)若开始时开关K与a连接,该装置是原电池,铁是负极,石墨是正极,电子从负极沿导线流向正极,电解质溶液中阳离子向正极移动,在弱酸性或中性条件下,钢铁发生吸氧腐蚀;
(2)若开关K与b连接,该装置是电解池,石墨作阳极,铁作阴极,阴极上得电子发生还原反应,阳极上失电子发生氧化反应,电解质溶液中阳离子向阴极移动,根据氯气和转移电子之间的关系式计算.
(2)若开关K与b连接,该装置是电解池,石墨作阳极,铁作阴极,阴极上得电子发生还原反应,阳极上失电子发生氧化反应,电解质溶液中阳离子向阴极移动,根据氯气和转移电子之间的关系式计算.
解答:解:(1)若开始时开关K与a连接,该装置是原电池,铁是负极,石墨是正极,负极上铁失电子生成亚铁离子,所以其电极反应式为:Fe-2e-=Fe 2+,
①该装置是原电池,铁易失电子而作负极,石墨作正极,即A为正极,B为负极,故正确;
②电子由电极B流出经导线流向A极,故错误;
③溶液中Na+向正极A极移动,故正确;
④该反应相当于在模拟钢铁的吸氧腐蚀,故错误;
故答案为:Fe-2e-=Fe 2+;①③;
(2)若开关K与b连接,该装置是电解池,石墨作阳极,铁作阴极,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,所以其电池反应式为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,
①B为阴极,发生还原反应,故错误;
②A极上氯离子放电,所以A极电极反应式可表示为2Cl-=Cl2↑+2e-,故正确;
③溶液中Na+向阴极B极移动,故错误;
④若标准状况下B极产生2.24L气体,则电路中通过的电子数为0.2NA,故正确;
故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;②④.
①该装置是原电池,铁易失电子而作负极,石墨作正极,即A为正极,B为负极,故正确;
②电子由电极B流出经导线流向A极,故错误;
③溶液中Na+向正极A极移动,故正确;
④该反应相当于在模拟钢铁的吸氧腐蚀,故错误;
故答案为:Fe-2e-=Fe 2+;①③;
(2)若开关K与b连接,该装置是电解池,石墨作阳极,铁作阴极,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,所以其电池反应式为:2Cl-+2H2O
| ||
①B为阴极,发生还原反应,故错误;
②A极上氯离子放电,所以A极电极反应式可表示为2Cl-=Cl2↑+2e-,故正确;
③溶液中Na+向阴极B极移动,故错误;
④若标准状况下B极产生2.24L气体,则电路中通过的电子数为0.2NA,故正确;
故答案为:2Cl-+2H2O
| ||
点评:本题考查原电池和电解池原理,明确离子的放电顺序及电极上发生的反应即可分析解答,注意无论电解池还是原电池中,电子都不进入溶液,为易错点.

练习册系列答案
相关题目
 (2008?东莞模拟)某课外活动小组同学用右图装置进行实验,试回答下列问题.
(2008?东莞模拟)某课外活动小组同学用右图装置进行实验,试回答下列问题. 气、氧气、硫酸和氢氧化钾.
气、氧气、硫酸和氢氧化钾. 某课外活动小组同学用右图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.
某课外活动小组同学用右图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题. 某课外活动小组同学用如图装置进行实验,试回答下列问题:
某课外活动小组同学用如图装置进行实验,试回答下列问题: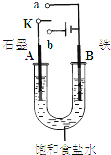 某课外活动小组同学用右图装置进行实验,试回答下列问题.
某课外活动小组同学用右图装置进行实验,试回答下列问题.