题目内容
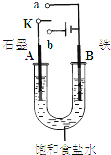 某课外活动小组同学用右图装置进行实验,试回答下列问题.
某课外活动小组同学用右图装置进行实验,试回答下列问题.(1)若开始时开关K与b连接,则B极的电极反应式为
总反应的离子方程式为
有关上述实验,下列说法正确的是(填序号)
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同)
④若标准状况下B极产生2.24L气体,则电路中转移0.2mol电子
(2)若开始时开关K与a连接,则B极的电极反应式为
分析:(1)若开始时开关K与b连接,则形成电解池,A为阳极,发生氧化反应,生成氯气,B为阴极,生成氢气和氢氧化钠;
(2)若开始时开关K与a连接,为原电池反应,铁为负极,发生吸氧腐蚀.
(2)若开始时开关K与a连接,为原电池反应,铁为负极,发生吸氧腐蚀.
解答:解:(1)开关K与b连接,装置为电解池,铁为阴极,发生还原反应,氢离子得到电子生成氢气,电极方程式为2H++2e-=H2↑,电解饱和食盐水生成氢氧化钠、氢气和氯气,总反应式为2Cl-+2H2O
2OH-+H2↑+Cl2↑,
①电解时阳离子向阴极移动,故①错误;
②A生成氯气,能使湿润KI淀粉试纸变蓝,故②正确;
③阳极生成氯气,阴极生成氢气,则通入适量氯化氢可恢复到原浓度,故③错误;
④若标准状况下B极产生2.24L氢气,由2H++2e-=H2↑可知转移0.2mol电子,故④正确.
故答案为:2H++2e-=H2↑;2Cl-+2H2O
2OH-+H2↑+Cl2↑;②④;
(2)开始时开关K与a连接,是原电池,铁为负极,发生氧化反应,失去电子生成亚铁离子,电极方程式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+.
| ||
①电解时阳离子向阴极移动,故①错误;
②A生成氯气,能使湿润KI淀粉试纸变蓝,故②正确;
③阳极生成氯气,阴极生成氢气,则通入适量氯化氢可恢复到原浓度,故③错误;
④若标准状况下B极产生2.24L氢气,由2H++2e-=H2↑可知转移0.2mol电子,故④正确.
故答案为:2H++2e-=H2↑;2Cl-+2H2O
| ||
(2)开始时开关K与a连接,是原电池,铁为负极,发生氧化反应,失去电子生成亚铁离子,电极方程式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+.
点评:本题综合原电池和电解质知识,侧重于学生的分析能力和电化学知识的综合应用,注意解题时要注意分析电极反应及生成物,难度中等.

练习册系列答案
相关题目
 某课外活动小组同学用如图装置进行实验,试回答下列问题.
某课外活动小组同学用如图装置进行实验,试回答下列问题. (2008?东莞模拟)某课外活动小组同学用右图装置进行实验,试回答下列问题.
(2008?东莞模拟)某课外活动小组同学用右图装置进行实验,试回答下列问题. 气、氧气、硫酸和氢氧化钾.
气、氧气、硫酸和氢氧化钾. 某课外活动小组同学用右图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.
某课外活动小组同学用右图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题. 某课外活动小组同学用如图装置进行实验,试回答下列问题:
某课外活动小组同学用如图装置进行实验,试回答下列问题: