题目内容
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)盖斯定律在生产和科学研究中有很重要的意义。已知把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
则△H1、△H2、△H3、△H4的数学关系式是 。
(1)N2H4(l)+2H2O2(l) == N2(g) +4H2O(g) △H=-641.75 KJ/mol (3分,方程式1分,数值1分,单位1分)
(2)817.75 (2分)
(3)产物不会造成环境污染 (2分)
(4)△H1=△H2+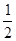 (△H3+△H4)或2△H1=2△H2+△H3+△H4(3分)
(△H3+△H4)或2△H1=2△H2+△H3+△H4(3分)
【解析】略

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案