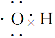题目内容
已知N、P同属元素周期表的第ⅤA族元素,N在第二周期,P在第三周期,NH3分子呈三角锥形,N原子位于锥顶,三个H原子位于锥底,N—H键间的夹角是107.3°。
(1)PH3分子与NH3分子的构型关系是____________(填“相同”、“相似”或“不相似”)______________(填“有”或“无”)P—H键,PH3分子是______________(填“极性”或“非极性”)分子。
(2)NH3与PH3相比,热稳定性更强的是____________,原因是_____________。
(3)NH3和PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是________________。
A.键的极性N—H比P—H强
B.分子的极性NH3比PH3强
C.相对分子质量PH3比NH3大
D.NH3分子之间存在特殊的分子间作用力
(1)相似 有 极性
(2)NH3 NH3分子中N—H 键键能比PH3分子中的P—H键键能大
(3)D
【解析】(1)N原子与P原子结构相似,NH3分子与PH3分子结构也相似。P—H键为不同种元素原子之间形成的共价键,为极性键。
(2)由N、P在元素周期表中的位置和元素周期律知,非金属性N比P强,由元素的非金属性与氢化物之间的热稳定性关系知,NH3比PH3热稳定性强,也可用键能来解释。
(3)“易液化”属于物质的物理性质,NH3与PH3都是分子晶体,其物理性质与化学键无关。按照相对分子质量与分子间作用力的关系和分子间作用力与物质的物理性质的关系分析,应该有PH3比NH3的沸点高,PH3比NH3易液化。而实际是NH3比PH3易液化,这种反常现象的客观存在必有特殊的原因,在NH3分子间存在着比范德华力较强的氢键的特殊的分子间作用力。

下列数据对应物质的熔点,据此作出下列判断中错误的是( )。
Na2O | NaCl | AlF3 | AlCl3 |
920 ℃ | 801 ℃ | 1 292 ℃ | 190 ℃ |
BCl3 | Al2O3 | CO2 | SiO2 |
-107 ℃ | 2 073 ℃ | -57 ℃ | 1 723 ℃ |
A.铝的化合物的晶体中有离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体