��Ŀ����
����Ŀ����.2017��08��08��21ʱ19��46�����Ĵ������ݾ�կ���ط���7�����𡣵����Ϊ��ֹ�߲����У�ȫ�����������������˴�������������Ư���ȡ���ش�����������⣺
��1������������һЩƯ��������������Ч�ɷ֡�84����Һ����Ч�ɷ��Ǵ������ƣ���ȡ������Һ�Ļ�ѧ����ʽΪ_______��
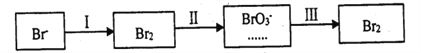
��2����������(ClO2)��Ŀǰ�����Ϲ��ϵĵ��Ĵ���Ч�����Ĺ�����������������KClO3��Һ��һ����������SO2��Ӧ�Ƶá��÷�Ӧ�����ӷ���ʽΪ��_______��
��3��Ư����������(NaClO2)�ڳ��ºڰ����ɱ���һ�꣬��������ȶ��ɷֽ⣬��Ӧ�����ӷ���ʽΪ��HClO2��ClO2��+H++Cl-+H2O(δ��ƽ)��
��1 molHClO2�����ֽⷴӦʱ��ת�Ƶ��ӵ����ʵ�����_________mo1��
��.�弰�仯����㷺Ӧ�����л��ϳɡ���ѧ����������
��4����ˮ�����������Ԫ�صı仯���£�
�ٹ���������ˮ�Լ��ԣ�����pH<3.5����ͨ������������ˮPH�����Cl2��������.��ƽ��ԭ��������ԭ����______________��
�ڹ����������ȿ�������ϳ�������Ũ̼������Һ���ա���ɲ���ƽ���з���ʽ��
_____Br2+_______Na2CO3 =______NaBrO3+_____CO2+____��
��5��NaBrO3��һ�ַ����Լ����������ữ��NaI��Һ����μ���NaBrO3��Һ��������2.6 mol NaBrO3ʱ����÷�Ӧ����Һ����͵�Ĵ�����ʽ�����ʵ����ֱ�Ϊ��
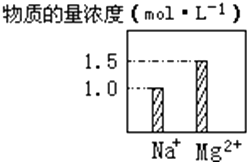
���� | I2 | Br2 | IO3- |
���ʵ���/mol | 0.5 | 1.3 |
��ԭ��Һ��NaI�����ʵ�����_______mol��
���𰸡� Cl2+2NaOH=NaCl+2NaClO+H2O 2ClO3-+SO2=2ClO2+SO42- 0.8 Cl2+H2O![]() H++Cl-+HClO������c(H+)��ƽ�������ƶ�������Cl2��ˮ�ķ�Ӧ 3 3 1 3 5NaBr 3
H++Cl-+HClO������c(H+)��ƽ�������ƶ�������Cl2��ˮ�ķ�Ӧ 3 3 1 3 5NaBr 3
����������1�����������ƺ�������Ӧ��ȡ����Һ����ѧ����ʽΪCl2+2NaOH=NaCl+2NaClO+H2O��
��2����KClO3��Һ��һ����������SO2��Ӧ�ƶ�������(ClO2)�����ӷ���ʽΪ2ClO3-+SO2=2ClO2+SO42-��
��3��������ȶ��ɷֽ⣬��Ӧ�����ӷ���ʽΪ��5HClO2=4ClO2��+H++Cl-+2H2O����Ӧ�е���ת�Ƶ���Ŀ��4e-�����Ե�1 molHClO2�����ֽⷴӦʱ��ת�Ƶ��ӵ����ʵ�����0.8mo1��
��. ��4���ٵ���ˮPH�����Cl2��������.��ƽ��ԭ��������ԭ����Cl2+H2O![]() H++Cl-+HClO������c(H+)��ƽ�������ƶ�������Cl2��ˮ�ķ�Ӧ��
H++Cl-+HClO������c(H+)��ƽ�������ƶ�������Cl2��ˮ�ķ�Ӧ��
�ڹ��̢����ȿ�������ϳ�������Ũ̼������Һ���գ���ѧ����ʽ��
3Br2+3Na2CO3 =NaBrO3+3CO2+5NaBr ��
��5��������֪��2.6 mol NaBrO3ǡ��ȫ��ת��Ϊ1.3mol Br2������+5�۽�Ϊ0������ת�Ƶ���13mol������0.5mol�⣬ת����1mol���ӣ�����NaIת��ΪIO3-��������ת����12mol��������Ļ��ϼ���-1���ߵ�+5�����Է������ֱ仯��n(NaI)= ![]() =2mol����ԭ��Һ��NaI�����ʵ�����0.5mol
=2mol����ԭ��Һ��NaI�����ʵ�����0.5mol![]() +2mol=3mol��
+2mol=3mol��

����Ŀ��������Ⱦ������Σ�������������ж�Ӧ��ϵ��ȷ���ǣ� ��
ѡ�� | �������� | ��ɻ����������Ҫ���� |
A | ����ЧӦ | CO2 |
B | �ϼ�������ն� | SO2 |
C | ���� | O3 |
D | �⻯ѧ���� | N2 |
A.AB.BC.CD.D