题目内容
【题目】在0.2L NaCl、MgCl2的混合溶液中,部分离子浓度大小如图所示,回答下列问题:
(1)该混合溶液中,Na+的物质的量为moL,MgCl2的物质的量为moL,Cl﹣的物质的量为moL.
(2)该混合溶液中含溶质的总质量为g.
(3)将该混合溶液加水稀释至体积为 1L,稀释后溶液中Cl﹣的物质的量浓度为 moLL﹣1 . 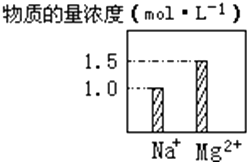
【答案】
(1)0.2;0.3;0.8
(2)40.2
(3)0.8
【解析】解:(1)溶液中c(Na+)=1mol/L,c(Mg2+)=1.5mol/L, 0.2L溶液中,n(Na+)=1mol/L×0.2L=0.2mol,n(Mg2+)=1.5mol/L×0.2L=0.3mol,
溶液中n(MgCl2)=n(Mg2+)=0.3mol,
根据电荷守恒可知:n(Cl﹣)=n(Na+)+2n(Mg2+)=0.2mol+0.3mol×2=0.8mol.
故答案为:0.2;0.3;0.8;(2)溶液中溶质为NaCl、MgCl2 , 溶质总质量=0.2mol×58.5g/mol+0.3mol×95g/mol=40.2g,
故答案为:40.2;(3)将该混合溶液加水稀释至体积为 1L,稀释后溶液中Cl﹣的物质的量浓度为 ![]() =0.8moLL﹣1 ,
=0.8moLL﹣1 ,
故答案为:0.8.
(1)根据n=cV计算n(Na+)、n(Mg2+),溶液中n(MgCl2)=n(Mg2+),根据电荷守恒可知,n(Cl﹣)=n(Na+)+2n(Mg2+);(2)溶液中溶质为NaCl、MgCl2 , 根据m=nM计算;(3)根据c= ![]() 计算.
计算.

练习册系列答案
相关题目