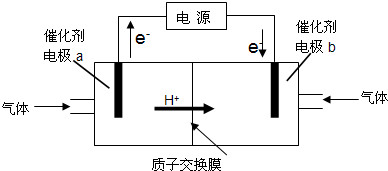
题目内容
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+ O2(g)═CO2(g)+2H2O(l).其工作原理示意图如下:
O2(g)═CO2(g)+2H2O(l).其工作原理示意图如下: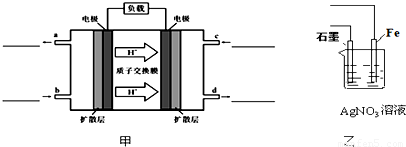
请回答下列问题:
(1)写出甲图中b、c两个入口通入的物质名称(或化学式)b______c______
(2)负极的电极反应式为______.
(3)用该原电池电解AgNO3溶液,若Fe电极增重5.4g,则燃料电池在理论上消耗的氧气的体积为______mL(标准状况)
【答案】分析:(1)根据氢离子的移动方向知,右边电极是正极,左边电极是负极,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,据此判断b、c电极上的物质;
(2)负极上甲醇失电子和水反应生成二氧化碳和氢离子;
(3)根据转移电子守恒计算.
解答:解:(1)根据氢离子的移动方向知,右边电极是正极,左边电极是负极,负极上投放燃料甲醇,正极上投放氧化剂氧气,故答案为:甲醇;氧气;
(2)负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为:CH3OH+H2O-6e-═CO2+6H+,故答案为:CH3OH+H2O-6e-═CO2+6H+;
③电解硝酸银溶液中,阴极上析出银,阳极上生成氧气,根据转移电子守恒知,氧气的体积=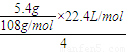 =0.28L=280mL,故答案为:280.
=0.28L=280mL,故答案为:280.
点评:本题考查燃料电池,明确燃料电池中正负极上得失电子是解本题关键,难点是书写电极反应式,注意要结合电解质溶液的酸碱性书写,为易错点.
(2)负极上甲醇失电子和水反应生成二氧化碳和氢离子;
(3)根据转移电子守恒计算.
解答:解:(1)根据氢离子的移动方向知,右边电极是正极,左边电极是负极,负极上投放燃料甲醇,正极上投放氧化剂氧气,故答案为:甲醇;氧气;
(2)负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为:CH3OH+H2O-6e-═CO2+6H+,故答案为:CH3OH+H2O-6e-═CO2+6H+;
③电解硝酸银溶液中,阴极上析出银,阳极上生成氧气,根据转移电子守恒知,氧气的体积=
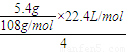 =0.28L=280mL,故答案为:280.
=0.28L=280mL,故答案为:280.点评:本题考查燃料电池,明确燃料电池中正负极上得失电子是解本题关键,难点是书写电极反应式,注意要结合电解质溶液的酸碱性书写,为易错点.

练习册系列答案
相关题目
近年来,各国加速推进燃料电池的研发.燃料电池的燃料有氢气、甲醇等.
(1)通过下列硫--碘循环工艺可制得燃料电池的燃料氢气:
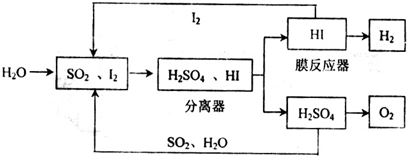
①该循环工艺过程的总反应方程式为 .
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是
(2)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l);△H=-283.0kJ?mol-1…①
2CH3OH(1)+3O2(g)→2CO2(g)+4H2O(1);△H=-726.0kJ?mol-1…②
写出二氧化碳与氢气合成甲醇液体的热化学方程式 .
(3)甲醇--空气燃料电池是利用稀土金属氧化物作为固体电解质,这种稀土金属氧化物在高温下能传导O2-.
①负极发生的反应是
②在稀土金属氧化物的固体电解质中,O2-.的移动方向是 .
(4)已知反应2CH30H?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此 温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小v正 v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH30H)= .
(1)通过下列硫--碘循环工艺可制得燃料电池的燃料氢气:

①该循环工艺过程的总反应方程式为
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是
(2)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l);△H=-283.0kJ?mol-1…①
2CH3OH(1)+3O2(g)→2CO2(g)+4H2O(1);△H=-726.0kJ?mol-1…②
写出二氧化碳与氢气合成甲醇液体的热化学方程式
(3)甲醇--空气燃料电池是利用稀土金属氧化物作为固体电解质,这种稀土金属氧化物在高温下能传导O2-.
①负极发生的反应是
②在稀土金属氧化物的固体电解质中,O2-.的移动方向是
(4)已知反应2CH30H?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此 温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH30H)=

 (2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.
(2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.