��Ŀ����
��̼������һ��ʱ�е���������������ǽ��ͽ��ܡ���Ч��������CO2��
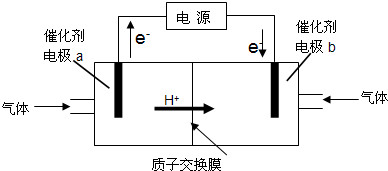
��1��������ͼ��ʾװ�ã���CO2��H2Ϊԭ���Ʊ��״���������ӦCO2+3H2
CH3OH+H2O��H2Ӧ�ӵ��ص� ����缫���ƣ�ͨ�룻����b�缫�ĵ缫��Ӧ����ʽΪ
��2�������������ZrO2��Ϊ�������ʣ��ܴ���O2-��������˳����µļ״�-����ȼ�ϵ�أ���ԭ�������0.5mol �״�����ʱ������������Ϊ360.0KJ��������O2-�����ʵ���Ϊ mol������ȼ�ϵ������������������״�������ȼ�����ͷŵ�ȫ������֮��Ϊ9��10�����ʾCH3OH ȼ���ȵ��Ȼ�ѧ����ʽΪ�� ��
��1��������ͼ��ʾװ�ã���CO2��H2Ϊԭ���Ʊ��״���������ӦCO2+3H2
| ||

��2�������������ZrO2��Ϊ�������ʣ��ܴ���O2-��������˳����µļ״�-����ȼ�ϵ�أ���ԭ�������0.5mol �״�����ʱ������������Ϊ360.0KJ��������O2-�����ʵ���Ϊ
��������1������ͼƬ�е�������֪��a�缫��������b�缫�����������ݷ���ʽ֪������ʧ���ӷ���������Ӧ����Ӧ���������Ϸŵ磬������̼�������ϵõ��ӷ�����ԭ��Ӧ��
��2������ת�Ƶ�����ȼ��������ӵ����ʵ��������ݷ�Ӧ�ȼ�Ĺ�ϵʽ����1mol�״��ų���������
��2������ת�Ƶ�����ȼ��������ӵ����ʵ��������ݷ�Ӧ�ȼ�Ĺ�ϵʽ����1mol�״��ų���������
����⣺��1������ͼƬ�е�������֪��a�缫��������b�缫�����������ݷ���ʽ֪������ʧ���ӷ���������Ӧ����Ӧ��������a�缫�Ϸ�����Ӧ��b�缫�϶�����̼�õ��Ӻ���ԭ�ӷ�Ӧ���ɼ״���ˮ���缫��ӦʽΪ��CO2+6H++6e-=CH3OH+H2O��
�ʴ�Ϊ��������CO2+6H++6e-=CH3OH+H2O��
��2������ת�Ƶ����غ�������ӵ����ʵ���=
=1.5mol������ȼ�ϵ������������������״�������ȼ�����ͷŵ�ȫ������֮��Ϊ9��10��������0.5mol�״�ȼ�շų�������Ϊ
=400kJ����1mol�״���ȫȼ�շų�����Ϊ800kJ�������Ȼ�ѧ��Ӧ����ʽΪCH3OH ��l��+1.5O2��g��=CO2��g��+2H2O��l����=-800KJ/mol��
�ʴ�Ϊ��1.5�� CH3OH ��l��+1.5O2��g��=CO2��g��+2H2O��l����=-800KJ/mol��
�ʴ�Ϊ��������CO2+6H++6e-=CH3OH+H2O��
��2������ת�Ƶ����غ�������ӵ����ʵ���=
| 0.5mol��(4+2) |
| 2 |
| 360kJ��10 |
| 9 |
=400kJ����1mol�״���ȫȼ�շų�����Ϊ800kJ�������Ȼ�ѧ��Ӧ����ʽΪCH3OH ��l��+1.5O2��g��=CO2��g��+2H2O��l����=-800KJ/mol��
�ʴ�Ϊ��1.5�� CH3OH ��l��+1.5O2��g��=CO2��g��+2H2O��l����=-800KJ/mol��
���������⿼���˵���ԭ�����Ȼ�ѧ��Ӧ����ʽ����д����ȷ�жϵ��ص��������ǽⱾ��ؼ����Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
��ѧ��������������Ϲ�ϵ���У�����˵������ȷ���ǣ�������
| A���������ɫ��Ӧ֪ʶ�йأ��������н������仯��������ʱ���������������ɫ | B����̼������һ��ʱ�е�������������������������ŷţ�CO2��CH4���dz������������� | C����ͥȼ��й©Ӧ����ͨ���Ա��ⱬը���� | D����ʯ�������Mg3��Si4O10����OH��2����������������ʽ��ʾΪ4MgO?4SiO2?H2O |