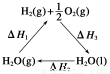
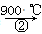ЬтФПФкШн
(1)МзДМПЩзїЮЊШМСЯЕчГиЕФдСЯЁЃвдCH4КЭH2OЮЊдСЯ,ЭЈЙ§ЯТСаЗДгІРДжЦБИМзДМЁЃ
Ђё:CH4 (g)+H2O(g)=CO(g)+3H2(g) ІЄH=+206.0 kJЁЄmol-1
Ђђ:CO(g)+2H2(g)=CH3OH(g) ІЄH=-129.0 kJЁЄmol-1
CH4(g)гыH2O(g)ЗДгІЩњГЩCH3OH (g)КЭH2(g)ЕФШШЛЏбЇЗНГЬЪНЮЊ ЁЃ
(2)МзДМЖдЫЎжЪЛсдьГЩвЛЖЈЕФЮлШО,гавЛжжЕчЛЏбЇЗЈПЩЯћГ§етжжЮлШО,ЦфдРэЪЧ:ЭЈЕчКѓ,НЋCo2+бѕЛЏГЩCo3+,ШЛКѓвдCo3+зїбѕЛЏМСАбЫЎжаЕФМзДМбѕЛЏГЩCO2ЖјОЛЛЏЁЃЪЕбщЪвгУШчЭМзАжУЪЕЯжЩЯЪіЙ§ГЬ:

ЂйаДГібєМЋЕчМЋЗДгІЪН: ЁЃ
ЂкаДГіГ§ШЅМзДМЕФРызгЗНГЬЪН: ЁЃ
(3)аДГівдNaHCO3ШмвКЮЊНщжЪЕФAlЁЊПеЦјдЕчГиЕФИКМЋЗДгІЪН: ЁЃ
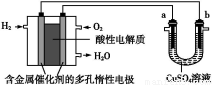
(4)ШЫЙЄЩідрПЩВЩгУМфНгЕчЛЏбЇЗНЗЈГ§ШЅДњаЛВњЮяжаЕФФђЫи,дРэШчЭМ:

ЂйЕчдДЕФИКМЋЮЊ (ЬюЁАAЁБЛђЁАBЁБ)ЁЃ
ЂкбєМЋЪвжаЗЂЩњЕФЗДгІвРДЮЮЊ ЁЃ
ЂлЕчНтНсЪјКѓ,вѕМЋЪвШмвКЕФpHгыЕчНтЧАЯрБШНЋ ;ШєСНМЋЙВЪеМЏЕНЦјЬх13.44 L(БъзМзДПі),дђГ§ШЅЕФФђЫиЮЊ g (КіТдЦјЬхЕФШмНт)ЁЃ
(1)CH4(g)+H2O(g)=CH3OH (g)+H2(g) ІЄH=+77.0 kJЁЄmol-1
(2)ЂйCo2+-e-=Co3+
Ђк6Co3++CH3OH+H2O=CO2Ёќ+6Co2++6H+
(3) Al-3e-+3HC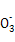 =Al(OH)3Ё§+3CO2Ёќ
=Al(OH)3Ё§+3CO2Ёќ
(4)ЂйB Ђк2Cl--2e-=Cl2ЁќЁЂCO(NH2)2+3Cl2+H2O=CO2+N2+6HCl
ЂлВЛБф 7.2
ЁОНтЮіЁП(1)Ђё:CH4(g)+H2O(g)=CO(g)+3H2(g) ІЄH=+206.0 kJЁЄmol-1
Ђђ:CO(g)+2H2(g)=CH3OH(g) ІЄH=-129.0 kJЁЄmol-1
Ђё+ЂђЕУ:CH4(g)+H2O(g)=CH3OH(g)+H2(g) ІЄH=+77.0 kJЁЄmol-1
(2)ИљОнЗДгІдРэ,ЭЈЕчКѓ,НЋCo2+бѕЛЏГЩCo3+,ШЛКѓвдCo3+зїбѕЛЏМСАбЫЎжаЕФМзДМбѕЛЏГЩCO2ЖјОЛЛЏ,дђЭЈЕчЪБCo2+ЪЇЕчзг,бєМЋЕФЕчМЋЗДгІЪНЮЊCo2+-e-=Co3+ЁЃГ§ШЅМзДМЕФРызгЗНГЬЪН6Co3++CH3OH+H2O=CO2Ёќ+6Co2++6H+ЁЃ
(3)AlЁЊПеЦјдЕчГиТСзїИКМЋ,ЪЇЕчзгЩњГЩТСРызг,КЭЬМЫсЧтФЦЗДгІЩњГЩЧтбѕЛЏТСКЭЖўбѕЛЏЬМЁЃИКМЋ:Al-3e-+3HC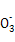 =Al(OH)3Ё§+3CO2ЁќЁЃ
=Al(OH)3Ё§+3CO2ЁќЁЃ
(4)ЂйгЩЭМПЩжЊВњЩњCl2ЕФЕчМЋЮЊбєМЋ,ЙЪAЮЊе§МЋ,BЮЊИКМЋЁЃЂкбєМЋЪвЗЂЩњЕФЗДгІЪзЯШЮЊ2Cl--2e-=Cl2ЁќЁЃгЩВњЮяCO2ЁЂN2ПЩжЊCO(NH2)2дкДЫЪвБЛбѕЛЏ,Cl2БЛЛЙд,ЙЪЗДгІЮЊCO (NH2)2+3Cl2+H2O=CO2+N2+6HClЁЃЂлвѕМЋЗЂЩњ2H++2e-=H2Ёќ,ЭЌЪБбєМЋЪвHClЕчРыГіЕФH+ЭЈЙ§жЪзгНЛЛЛФЄНјШывѕМЋЪв,ДгЖјЪЙвѕМЋЪвH+ХЈЖШБЃГжВЛБф,МДpHгыЕчНтЧАЯрБШВЛБфЁЃСНМЋЙВЪеМЏЕНЕФЦјЬхn(ЦјЬх)=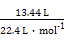 =0.6 mol,гЩ:
=0.6 mol,гЩ:
CO(NH2)2ЁЋ3Cl2ЁЋ3H2ЁЋCO2ЁЋN2
60 g 5 mol
m[CO(NH2)2] 0.6 mol
ЕУ:m[CO(NH2)2]=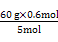 =7.2 gЁЃ
=7.2 gЁЃ

 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ