题目内容
14.将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)═2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 | |||||
| (×10-3 mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
(2)判断氨基甲酸铵分解反应的△H>0(填“>”、“<”或“=”),其原因是什么?由表格中,数据可知:升高温度,气体的平衡总浓度增大,平衡正向移动,故△H>0
(3)判断氨基甲酸铵分解反应的△S>_0(填“>”、“<”或“=”),该反应在任何温度下是否一定能自发进行?高温下反应能自发进行.
(4)升高温度,化学平衡常数K如何变化?增大,增大容器的压强,K值如何变化?不变.(填“变大”“变小”或“不变”).
(5)根据表格中的数据,计算25℃时,氨基甲酸铵的分解平衡常数1.6×10-8.
(6)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡,判断该分解反应已经达到化学平衡的是C
A.2v(NH3)=v(CO2) B.密闭容器中混合气体平均分子量不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变.
分析 (1)化学平衡常数K=$\frac{生成物平衡浓度系数次方的乘积}{反应物平衡浓度系数次方的乘积}$,固体和纯溶剂不列入表达式中;
(2)根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡正向移动,反应是吸热;
(3)根据反应前后气体量的变化来确定熵变的符号,该温度下能自发进行原因是△G<0;据此分析;
(4)平衡常数仅与温度有关,改变温度平衡正向移动,K增大,平衡逆向移动,K减小;
(5)根据K=c2(NH3)•c(CO2)计算;
(6)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,由此进行判断;
解答 解:(1)反应NH2COONH4(s)?2NH3(g)+CO2(g)的K=c2(NH3)•c(CO2),故答案为:K=c2(NH3)•c(CO2);
(2)根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡正向移动,反应是吸热的,即△H>0,故答案为:>;由表格中,数据可知:升高温度,气体的平衡总浓度增大,平衡正向移动,故△H>0;
(3)反应物是固体,产物是气体,该反应是熵增加的过程,即△S>0,因为△G<0能自发进行,又△H>0,△S>0,所以高温下反应能自发进行,故答案为:>;高温下反应能自发进行;
(4)平衡常数仅与温度有关,因为该反应△H>0,则升高温度平衡正向移动,K增大;增大容器的压强,K值不变,故答案为:增大;不变;
(5)设二氧化碳浓度的变化量x,
NH2COONH4(s)?2NH3(g)+CO2(g)
初始浓度:0 0
变化浓度:2x x
平衡浓度:2x x
则3x=4.8×10-3mol/L,即x=1.6×10-3mol/L,K=1.6×10-3mol/L×(3.2×10-3)2≈1.6×10-8,故答案为:1.6×10-8;
(6)A.2v(NH3)═v(CO2),未指明正逆反应,不能说明正逆反应速率相等,不一定是平衡状态,故A错误;
B.反应NH2COONH4(s)═2NH3(g)+CO2(g),反应后氨气和二氧化碳的体积之比一直未2:1,所以混合气体平均分子量一直不变,不能证明达到平恒状态,故B错误;
C.密闭容器中混合气体的密度ρ=$\frac{m}{V}$,质量不守恒,分子变化,V不变,容器中总密度不变,证明达到了平衡状态,故C正确;
D.密闭容器中氨气的体积分数不变,不能证明达到平恒状态,故D错误.
故选C.
点评 本题涉及化学平衡的判断、化学平衡常数的计算、化学平衡的移动等知识,属于综合知识的考查,难度不大.

 ABC考王全优卷系列答案
ABC考王全优卷系列答案| A. | 铝便于运输、贮存,从安全角度考虑,铝是最佳燃料之一 | |
| B. | 铝资源比较丰富,易于开采,且可以再生 | |
| C. | 铝燃烧热大,燃烧污染小,易有效控制 | |
| D. | 寻找高效催化剂,使A12O3分解同时释放能量,是铝能源大规模开发利用的一项关键技术 |
| A. | ①是化合反应 | |
| B. | ②变白色是因为生成了碳酸钠 | |
| C. | ③是碳酸钠吸收空气中的水蒸气形成了溶液 | |
| D. | ④只发生物理变化 |
| A. | 油与脂肪 | B. | 淀粉与纤维素 | C. | 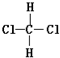 和 和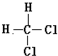 | D. | 正丁烷和异丁烷 |
①废旧报纸
②废铜钱
③一次性塑料盒
④口香糖渣
⑤果皮
⑥空矿泉水瓶
⑦废铁锅.
| A. | ①③⑤⑦ | B. | ③④⑤⑥ | C. | ①②⑤⑦ | D. | ①②⑥⑦ |
| A. | 0.1mo1•L-1MgCl2溶液中含C1一数为0.2 NA | |
| B. | 标准状况下,22.4L的CCl4中含CCl4分子数为NA | |
| C. | 0.1molNa2O2与足量的CO2完全反应转移电子数目为0.1NA | |
| D. | 10mL5mol•L-1(NH4)2CO3溶液中含有N原子数目小于0.1 NA |
| A. |  铜的冶炼 | B. | 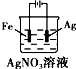 铁上镀银 | C. |  防止Fe被腐蚀 | D. |  构成铜锌原电池 |



