题目内容
4.工业制A1,你认为说法不妥当的是( )| A. | 铝便于运输、贮存,从安全角度考虑,铝是最佳燃料之一 | |
| B. | 铝资源比较丰富,易于开采,且可以再生 | |
| C. | 铝燃烧热大,燃烧污染小,易有效控制 | |
| D. | 寻找高效催化剂,使A12O3分解同时释放能量,是铝能源大规模开发利用的一项关键技术 |
分析 A.Al为固体,且密度较小,铝燃烧放出的热量大,是安全燃料;
B.Al大量存在于矿石中,来源丰富;
C.铝燃烧生成氧化铝,燃烧反应放出热量,氧化铝对环境无污染;
D.Al2O3分解产生铝,但需要吸收能量.
解答 解:A.因Al为固体,且密度较小,则铝质轻,便于运输、贮存,且安全,故A正确;
B.Al是地壳中含量最多的金属元素,大量存在于矿石中,则铝矿资源比较丰富,故B正确;
C.Al燃烧时放出热量较大,且生成的氧化铝,则对环境的污染容易得到有效的控制,故C正确;
D.铝燃烧放出热量,寻找高效催化剂,使Al2O3分解产生铝需要吸收能量,故D错误;
故选D.
点评 本题考查Al的性质和能源,熟悉Al的物理性质和化学性质,并把握信息中利用铝粉作为新能源的可能性,以期铝能成为一种石油的取代物是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
15.在一恒温恒容的密闭容器中,放入一定量的甲醇,发生反应:CH3OH(l)?CO(g)+2H2(g).以下可以作为该反应达到平衡状态的判断依据为( )
| A. | 容器内气体密度保持不变 | |
| B. | 气体的平均相对分子质量保持不变 | |
| C. | CO的体积分数保持不变 | |
| D. | CO与H2的物质的量之比保持1:2不变 |
12.由CH3CH2Cl合成HOCH2CH2OH 的反应类型有:①取代(水解)反应 ②加成反应③消去反应④氧化反应.按反应的先后顺序最合理的反应组合是( )
| A. | ①② | B. | ①③② | C. | ③②① | D. | ③②①④ |
19.在下列反应中,生成物总能量比反应物总能量要高的是( )
| A. | 氧化钙溶于水 | B. | 酒精完全燃烧 | C. | 食物氧化腐败 | D. | 高温煅烧石灰石 |
9.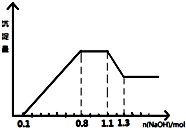 某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
 某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+ | |
| B. | 溶液中一定不含CO32-和NO3-,一定含有SO42- | |
| C. | 溶液中c(NH4+)=0.3 mol/L | |
| D. | c(H+):c(Al3+):c(Mg2+)=1:1:1 |
16.下列有关物质分类的描述正确的是( )
| A. | 金属氧化物一定是碱性氧化物 | |
| B. | SO2水溶液能导电,所以 SO2是电解质 | |
| C. | 胶体是纯净物,可以用丁达尔效应鉴别胶体和溶液 | |
| D. | 人们在认识事物时往往需要采用多种分类方法,来弥补单一分类方法的不足 |
13.下列说法中,正确的是( )
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 破坏生成物全部化学键所需要的能量小于破坏反应物全部化学键所需要的能量时,反应为放热反应 | |
| C. | 反应产物的总焓大于反应物的总焓时,即△H>0,反应吸热 | |
| D. | △H的大小与热化学方程式的化学计量数无关 |
14.将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)═2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:
(1)氨基甲酸铵(NH2COONH4)分解反应平衡常数K的表达式为K=c2(NH3)•c(CO2).
(2)判断氨基甲酸铵分解反应的△H>0(填“>”、“<”或“=”),其原因是什么?由表格中,数据可知:升高温度,气体的平衡总浓度增大,平衡正向移动,故△H>0
(3)判断氨基甲酸铵分解反应的△S>_0(填“>”、“<”或“=”),该反应在任何温度下是否一定能自发进行?高温下反应能自发进行.
(4)升高温度,化学平衡常数K如何变化?增大,增大容器的压强,K值如何变化?不变.(填“变大”“变小”或“不变”).
(5)根据表格中的数据,计算25℃时,氨基甲酸铵的分解平衡常数1.6×10-8.
(6)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡,判断该分解反应已经达到化学平衡的是C
A.2v(NH3)=v(CO2) B.密闭容器中混合气体平均分子量不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变.
NH2COONH4(s)═2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 | |||||
| (×10-3 mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
(2)判断氨基甲酸铵分解反应的△H>0(填“>”、“<”或“=”),其原因是什么?由表格中,数据可知:升高温度,气体的平衡总浓度增大,平衡正向移动,故△H>0
(3)判断氨基甲酸铵分解反应的△S>_0(填“>”、“<”或“=”),该反应在任何温度下是否一定能自发进行?高温下反应能自发进行.
(4)升高温度,化学平衡常数K如何变化?增大,增大容器的压强,K值如何变化?不变.(填“变大”“变小”或“不变”).
(5)根据表格中的数据,计算25℃时,氨基甲酸铵的分解平衡常数1.6×10-8.
(6)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡,判断该分解反应已经达到化学平衡的是C
A.2v(NH3)=v(CO2) B.密闭容器中混合气体平均分子量不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变.