题目内容
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,工业上可用NO与Cl2合成,回答下列问题:
(1)—定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及热化学方程式和平衡常数如下表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g) +NaCl(s) | K1 |
② | 4NO2(g) +2NaCl(s) | k2 |
③ | 2NO(g)+Cl2(g) | K3 |
K3=_______(用K1、K2表示)。
(2)25℃时,向体积为2L且带气压计的恒容密闭容器中通入0.08molNO和0.04molCl2发生反应:2NO(g)+Cl2(g) ![]() 2ClNO(g) △H3。
2ClNO(g) △H3。
① 下列描述能说明该反应已达到平衡状态的是_____(填序号)
a.v正(Cl2)=2v逆(NO) b.容器内混合气体的密度保持不变
c.容器内气体压强保持不变 d.容器内混合气体的平均相对分子质量保持不变
②若反应起始和平衡时温度相同,测得反应过程中压强(P)随时间(t)的变化如图I曲线a所示,则△H3______0(填“ >”、“ < ”或“不确定");若其他条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图I曲线b所示,則改变的条件是_________。
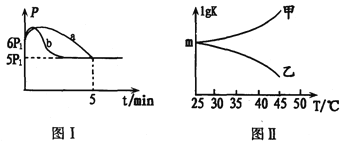
③图II是甲、乙同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”);m值为_______。
【答案】 K12/K2 cd < 加催化剂 乙 2
【解析】试题分析:(1)根据方程式2NO(g)+Cl2(g) ![]() 2ClNO(g)可由①×2-②得到,分析K3与K1、K2的关系;(2)①达到平衡状态时,v正:v逆=系数比;根据
2ClNO(g)可由①×2-②得到,分析K3与K1、K2的关系;(2)①达到平衡状态时,v正:v逆=系数比;根据![]() ,密度是恒量;反应前后气体系数和不同,压强为该反应的变量;
,密度是恒量;反应前后气体系数和不同,压强为该反应的变量; 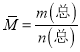 ,混合气体的平均相对分子质量是变量。
,混合气体的平均相对分子质量是变量。
②正反应气体物质的量减少,但开始压强增大,说明反应放热;若其他条件相同,改变后压强不变,说明平衡没移动。③△H3<0,升高温度,平衡逆向移动,平衡常数减小;根据图Ⅰ同温、同体积的气体压强比等于物质的量比计算平衡时的浓度。
解析:(1)①×2-②得到2NO(g)+Cl2(g) ![]() 2ClNO(g), K3= K12/K2;
2ClNO(g), K3= K12/K2;
(2)25℃时,向体积为2L且带气压计的恒容密闭容器中通入0.08molNO和0.04molCl2发生反应:2NO(g)+Cl2(g) ![]() 2ClNO(g) △H3。
2ClNO(g) △H3。
①达到平衡状态时,即2v正(Cl2)= v逆(NO),故a错误;根据![]() ,气体质量、气体体积都不变,所以密度是恒量,容器内混合气体的密度保持不变不一定平衡,故b错误;反应前后气体系数和不同,压强为该反应的变量,容器内气体压强保持不变,一定平衡,故c正确;
,气体质量、气体体积都不变,所以密度是恒量,容器内混合气体的密度保持不变不一定平衡,故b错误;反应前后气体系数和不同,压强为该反应的变量,容器内气体压强保持不变,一定平衡,故c正确; 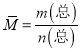 ,气体物质的量是变量,所以混合气体的平均相对分子质量是变量,容器内混合气体的平均相对分子质量保持不变,一定平衡,故d正确。
,气体物质的量是变量,所以混合气体的平均相对分子质量是变量,容器内混合气体的平均相对分子质量保持不变,一定平衡,故d正确。
②正反应气体物质的量减少,但开始压强增大,说明反应放热,所以△H3<0;若其他条件相同,改变后压强不变,说明平衡没移动,所以改变条件是加入催化剂。③△H3<0,升高温度,平衡逆向移动,平衡常数减小,lgK 随温度升高而减小,故乙正确;
根据图Ⅰ
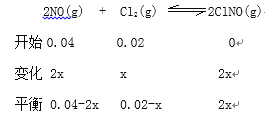
![]()
X=0.01
 , lgK=2。
, lgK=2。

【题目】某化学兴趣小组利用下图装置进行乙酸乙酯合成和分离的实验探究,请回答以下问题

(1)写出合成乙酸乙酯的化学方程式_______________________________。
(2)仪器b的名称________,图中起冷凝回流作用的是______(填a、b、c、d、e)。
(3)为了提高乙酸乙酯的产率可采取的措施 _______________________________
(4)经过0.5h加热反应后,将反应装置c中粗产品转移至d中进行蒸馏。
物质 | 98.3%浓硫酸 | 乙酸乙酯 | 乙酸 | 乙醇 | 乙醚 | 水 |
沸点 | 338℃, | 77.1℃ | 118℃ | 78.5℃ | 34.6℃ | 100℃ |
根据上表分析,蒸馏后得到的乙酸乙酯中,最有可能含有________________杂质。