题目内容
4.乙酸乙酯广泛存在于菠萝、香蕉等果品中.实验室制备乙酸乙酯的有关信息如表,装置如图1所示.| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解度 | |
| 乙醇 | 46 | 0.789 | 78.3 | 溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸乙酯 | 88 | 0.897 | 77 | 微溶 |
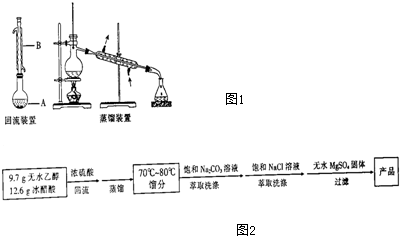
(1)仪器B的名称是球形冷凝管.
(2)制取乙酸乙酯的化学方程式为CH3COOH+C2H5OH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(3)本实验采取先回流后蒸馏的优点是减少乙醇蒸发,提高酯的产量.
(4)馏分用饱和的Na2CO3溶液洗涤是为了除去乙酸和乙醇.
(5)馏分用饱和的NaCl溶液洗涤是为了除去除去碳酸钠或醋酸钠或乙醇或水(填一种),酯在分流漏斗的上(填“上”或“下”)层.
(6)经洗涤的馏分加入少量无水MgSO4固体的作用是除去水分.
(7)经以上分离操作后,产品中还含有的杂质是乙醇,需进一步进行的提纯操作是d(填字母).
a.过滤 b.重结晶 c.萃取 d.精细蒸馏
(8)经进一步提纯后,得乙酸乙酯13.2g,则产率为71.4%.
分析 (1)根据仪器B的构造写出其名称;
(2)乙醇与乙酸在浓硫酸作用下加热反应生成乙酸乙酯和水;
(3)通过先回流的方法可以减少乙醇的蒸发,提高反应物转化率;
(4)碳酸钠能够中和乙酸、吸收乙醇,乙酸乙酯中混有乙酸和乙醇;
(5)乙醇、碳酸钠、醋酸钠等都能够溶于饱和氯化钠溶液;乙酸乙酯的密度小于水,分层后乙酸乙酯在分液漏斗的上层;
(6)硫酸镁固体能够吸收水分,据此判断其作用;
(7)乙酸乙酯中混有的乙酸、水都已经除去,还剩余乙醇没有除尽,需要通过精细蒸馏进一步除去杂质乙醇;
(8)根据n=$\frac{m}{M}$计算出乙醇、乙酸、乙酸乙酯的物质的量,根据反应判断过量情况,根据不足量计算出生成乙酸乙酯的物质的量,最高价m=nM计算出理论上生成乙酸乙酯的质量,最后计算出乙酸乙酯的产率.
解答 解:(1)根据图示可知,仪器B的名称为球形冷凝管,
故答案为:球形冷凝管;
(2)乙酸和乙醇发生酯化反应的化学方程式为:CH3COOH+C2H5OH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(3)乙醇沸点较低,通过回流可以减少乙醇蒸发,从而提高酯的产量,
故答案为:减少乙醇蒸发,提高酯的产量;
(4)通过蒸馏获得的乙酸乙酯中会混有部分乙酸和乙醇,碳酸钠溶液能够中和乙酸、吸收乙醇,所以馏分用饱和的Na2CO3溶液洗涤是为了除去乙酸和乙醇,
故答案为:乙酸和乙醇;
(5)馏分用饱和的NaCl溶液洗涤是为了除去碳酸钠、乙酸、乙醇和水;乙酸乙酯的密度小于水,则分液后乙酸乙酯在上层,
故答案为:除去碳酸钠或醋酸钠或乙醇或水;上;
(6)无水硫酸镁具有吸收性,经洗涤的馏分加入少量无水MgSO4固体可以除去馏分中的水分,
故答案为:除去水分;
(7)根据制备流程可知,乙酸已经用碳酸钠除去,水用无水硫酸镁除去,所以制取的乙酸乙酯中还会含有乙醇;需要经过d-精细蒸馏除去乙酸乙酯中混有的乙醇,
故答案为:乙醇;d;
(8)9.7g无水乙醇的物质的量为:$\frac{9.7g}{46g/mol}$≈0.211mol,12.6g冰醋酸的物质的量为:$\frac{12.6g}{60g/mol}$=0.21mol,根据反应CH3COOH+C2H5OH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O可知,显然乙醇过量,二者完全反应理论上生成乙酸乙酯的物质的量为0.21mol,质量为:88g/mol×0.21mol=18.48g,
则乙酸乙酯的产率为:$\frac{13.2g}{18.48g}$×100%≈71.4%,
故答案为:71.4%.
点评 本题考查乙酸乙酯的制取方法,题目难度中等,涉及知识点较多,考查较细,充分培养了学生的分析、理解能力及灵活应用基础知识的能力,注意掌握乙酸乙酯的制备原理,明确化学实验基本操作方法.

①C2H2与C2H4O ②C4H8与C6H12O6 ③C7H8与C6H12 ④HCOOCH3与CH3COOH.
| A. | ①③④ | B. | ①②③④ | C. | ①④ | D. | ①②④ |
| A. | 制作印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 用石墨棒作电极电解CuCl2溶液:Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$ Cu+Cl2↑ | |
| C. | 硫酸铝溶液与过量氢氧化钠溶液反应的离子方程式:Al3++3OH-═Al(OH)3↓ | |
| D. | 用醋酸巧除水垢的反应:CaC03+2H+═Ca2++C02↑+H20 |
CH4(g)+2O2(g)═CO2(g)+2H2O(g)(放热反应),
催化反应室发生的反应为(不考虑其他平衡的存在):CH4(g)+H2O(g)?CO(g)+3H2(g)(吸热反应);CH4(g)+CO2(g)?2CO(g)+2H2(g)(吸热反应),
下列说法正确的是( )
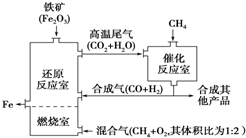
| A. | 加入铁矿石时,将铁矿石粉碎,目的是加快反应速率提高原料利用率 | |
| B. | 增大催化反应室的压强,甲烷的转化率增大 | |
| C. | 设置燃烧室的目的是产生CO2和水蒸气作原料气与甲烷反应 | |
| D. | 催化反应室需维持在550~750℃,目的仅是提高CH4转化的速率 |
| A. | SO32-、K+、NH4+ | B. | K+、I-、Cl- | C. | Na+、NH4+、S2- | D. | Na+、ClO-、NO3- |
| A. | 用灼烧的方法可以鉴别羊毛和棉花 | |
| B. | 用饱和碳酸钠溶液除去乙酸乙酯中的乙酸 | |
| C. | 用酒精清洗沾到皮肤上的苯酚 | |
| D. | 用酸性高猛酸钾溶液鉴别甲苯和苯乙烯 |
| A. | 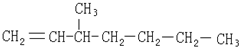 | B. | 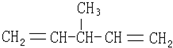 | ||
| C. | 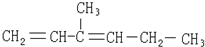 | D. | 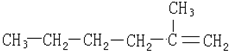 |
| A. | O3是氧的一种同位素,其中含有共价键,属于共价化合物 | |
| B. | NaOH、HNO3中都含有离子键和共价键 | |
| C. | 235U、238U是两种不同核素,属于同一种元素 | |
| D. | 已知石墨合成金刚石是吸热反应,金刚石比石墨稳定 |
| A. | 都容易发生取代反应 | B. | 都能被酸性KMnO4氧化 | ||
| C. | 苯不能发生加成反应 | D. | 都能在空气中燃烧 |