题目内容
10.将a g含NaOH的样品溶解在b mL 0.1mol/L的H2SO4中,再加入c mL 0.1mol/L的NaOH溶液.反应后所得溶液恰好呈中性,样品中NaOH的纯度是$\frac{(2b-c)}{250a}$×100%.分析 发生反应:2NaOH+H2SO4═Na2SO4+2H2O,根据n=cV计算硫酸的物质的量,根据方程式计算NaOH总物质的量,进而计算样品中NaOH的物质的量,根据m=nM计算样品中NaOH的质量,进而计算NaOH质量分数.
解答 解:硫酸的物质的量为:b×10-3 L×0.1mol/L=b×10-4mol,
2 NaOH+H2SO4═Na2SO4+2H2O
2b×10-4mol b×10-4mol
故原样品中NaOH为:2b×10-4mol-c×10-3 L×0.1mol/L=(2b-c)×10-4mol,
则m(NaOH)=(2b-c)×10-4mol×40g/mol=(8b-4c)×10-3g,
故样品中NaOH的纯度是$\frac{(8b-4c)×1{0}^{-3}g}{ag}$×100%=$\frac{(2b-c)}{250a}$×100%,
故答案为:$\frac{(2b-c)}{250a}$×100%.
点评 本题考查化学方程式的有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
20.下列化合物中只含有离子键的是( )
| A. | KOH | B. | H2O | C. | CaCl2 | D. | NH3 |
1.已知常温下,0.1mol•L-1CH3COONH4溶液呈中性.下列有关叙述正确的是( )
| A. | 该溶液可由等体积、浓度均为0.1mol•L-1的醋酸和氨水反应得到 | |
| B. | CH3COONH4加人纯水中,水的电离程度不变 | |
| C. | 常温下,电离平衡常数K(CH3 COOH)=K(NH3•H2 O) | |
| D. | 该溶液中c(CH3 COO-)大于同浓度CH3 COONa溶液中的c(CH3 COO-) |
5. (1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
(1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
①由表判断,NaHSO3溶液显酸性,用化学平衡原理解释:溶液中存在:HSO3?SO32-+H+;HSO3-+H2O?H2SO3+OH-电离程度大于水解程度,故溶液显酸性.
②请写出Na2SO3溶液中离子浓度大小关系:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
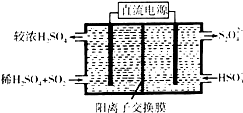
(2)利用图示装置(电极均为惰性电极)吸收SO2,由阴极排出的溶液可吸收NO2.
①阴极的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O.
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成.写出该反应离子方程式:4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O.
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收的产物反应,得到一种复合肥.
①该复合肥料可能的化学式为(NH4)3PO4(或(NH4)2HPO4或NH4H2PO4)(只写一种).
②若氨水与SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”“碱”或“中”).已知常温下NH3•H2O的Kb=1.8×10-5mol•L-1,H2SO3的Ka1=1.3×10-2mol•L-1Ka2=6.3×10-8mol•L-1.
③当氨水吸收SO2至恰好完全反应形成正盐时,反应过程中H2O的电离平衡移动方向为向右(填“向左”“向右”或“不”).
 (1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
(1)利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②请写出Na2SO3溶液中离子浓度大小关系:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
(2)利用图示装置(电极均为惰性电极)吸收SO2,由阴极排出的溶液可吸收NO2.
①阴极的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O.
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成.写出该反应离子方程式:4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O.
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收的产物反应,得到一种复合肥.
①该复合肥料可能的化学式为(NH4)3PO4(或(NH4)2HPO4或NH4H2PO4)(只写一种).
②若氨水与SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”“碱”或“中”).已知常温下NH3•H2O的Kb=1.8×10-5mol•L-1,H2SO3的Ka1=1.3×10-2mol•L-1Ka2=6.3×10-8mol•L-1.
③当氨水吸收SO2至恰好完全反应形成正盐时,反应过程中H2O的电离平衡移动方向为向右(填“向左”“向右”或“不”).
2.某有机物的结构为 ,下列关于该有机物性质的说法错误的是( )
,下列关于该有机物性质的说法错误的是( )
 ,下列关于该有机物性质的说法错误的是( )
,下列关于该有机物性质的说法错误的是( )| A. | 能跟NaOH溶液反应 | |
| B. | 1mol该有机物与足量的钠反应产生2mol H2 | |
| C. | 能发生酯化反应 | |
| D. | 能使酸性KMnO4溶液褪色 |
下表为各物质中所含有的少量杂质以及除去这些杂质应选用的试剂或操作方法。正确的一组是 ( )
序号 | 物质 | 杂质 | 除杂应选用的试剂或操作方法 |
① | KNO3 | KOH | 加入FeCl3溶液,并过滤 |
② | Fe(NO3)2溶液 | AgNO3溶液 | 加入足量铁粉,并过滤 |
③ | O2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | CaO | CaCO3 | 加入稀盐酸,再蒸发 |
A.①④ B.② C.②④ D.②③
 钛、铜可以作为多种催化剂的主体.如以TiO2覆盖在Cu2Al2O4表面作催化剂,可以将CO2与CH4直接转化成乙酸.
钛、铜可以作为多种催化剂的主体.如以TiO2覆盖在Cu2Al2O4表面作催化剂,可以将CO2与CH4直接转化成乙酸.