题目内容
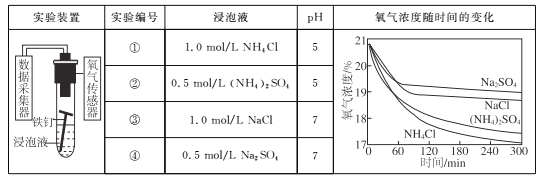
【题目】利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如下图所示。
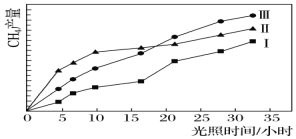
(1)在0~30小时内,CH4的平均生成速率vⅠ、vⅡ、vⅢ从大到小的顺序为__________;反应开始后的12小时内,在第________种催化剂作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206 kJ·mol-1。
①在下列坐标图中,画出反应过程中体系能量变化图(进行必要标注)。________;

②将等物质的量的CH4和H2O(g)充入1 L恒容密闭反应器,某温度下反应达平衡,平衡常数K=27,此时测得CO的物质的量为0.10 mol,则CH4的平衡转化率为________(结果保留两位有效数字)。
(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802 kJ·mol-1,写出由CO2生成CO的热化学方程式:_____________。
【答案】vⅢ>vⅡ>vⅠ Ⅱ 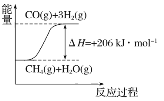 91% CO2(g)+3H2O(g)=CO(g)+2O2(g)+3H2(g) ΔH=+1 008 kJ·mol-1
91% CO2(g)+3H2O(g)=CO(g)+2O2(g)+3H2(g) ΔH=+1 008 kJ·mol-1
【解析】
(1)根据图像分析解答;
(2)CH4(g)+H2O(g)![]() CO(g)+3H2(g),该反应的△H=+206kJmol-1,反应是吸热反应,反应物能量低于生成物能量;根据能量变化画出图象;
CO(g)+3H2(g),该反应的△H=+206kJmol-1,反应是吸热反应,反应物能量低于生成物能量;根据能量变化画出图象;
(3)根据三行式法计算得到转化率;
(4)根据盖斯定律计算。
(1)由图可以知道,在0~30h内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅱ)<△n(Ⅲ),故在0~30h内,CH4的平均生成速率v(Ⅲ)>v(Ⅱ)>v(Ⅰ);由图可以知道反应开始后的12小时内,在第Ⅱ种催化剂的作用下,收集的CH4最多;答案:vⅢ>vⅡ>vⅠ;Ⅱ
(2)CH4(g)+H2O(g)![]() CO(g)+3H2(g),该反应的△H=+206kJmol-1,反应是吸热反应,反应过程中体系的能量变化图为:
CO(g)+3H2(g),该反应的△H=+206kJmol-1,反应是吸热反应,反应过程中体系的能量变化图为: ;
;
答案: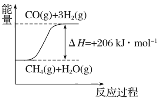
(3)将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数k=27,此时测得CO的物质的量为0.10mol,根据平衡的三步计算可求CH4的平衡转化率。
CH4(g) + H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始量(mol) x x 0 0
变化量(mol) 0.10 0.10 0.10 0.30
平衡量(mol) x-0.10 x-0.10 0.10 0.30
K=![]() =
=![]() =27
=27
计算得到x=0.11mol
甲烷的转化率=![]() ×100%≈91%;
×100%≈91%;
答案:91%
(4)CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206 kJ·mol-1 ①
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802 kJ·mol-1 ②
根据盖斯定律①-②得到:CO2(/span>g)+3H2O(g)=CO(g)+2O2(g)+3H2(g) ΔH=+1008 kJ·mol-1;
答案:CO2(g)+3H2O(g)=CO(g)+2O2(g)+3H2(g) ΔH=+1008 kJ·mol-1。