题目内容
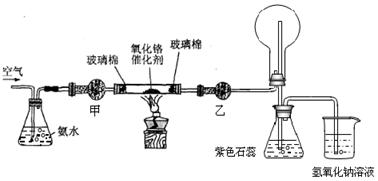
如图1所示,某兴趣小组同学将铜片加入稀硝酸,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。

图 1 图 2
(1)图1中铜与稀硝酸反应的离子方程式为 ;
用离子方程式表示NaOH溶液所起的作用 ;
(2)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是 ;
测定反应过程中溶液不同时间的温度,结果如下表:
结合实验目的和表中数据,你得出的结论是 ;
Ⅱ.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的 (填序号)。
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。因此得出结论:Cu2+并不是反应的催化剂。
Ⅲ. 丙同学根据现象推测反应过程中还有少量 生成,进而认为该物质对反应有催化作用,如图2所示,实验中丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
(3)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中硝酸铜的质量分数较高所致,另一部分同学认为是该溶液中溶解了通入的物质。请你设计一个实验方案来证明哪种假设正确。(写出实验操作、实验现象和结论) 。

图 1 图 2
(1)图1中铜与稀硝酸反应的离子方程式为 ;
用离子方程式表示NaOH溶液所起的作用 ;
(2)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是 ;
测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
结合实验目的和表中数据,你得出的结论是 ;
Ⅱ.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的 (填序号)。
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。因此得出结论:Cu2+并不是反应的催化剂。
Ⅲ. 丙同学根据现象推测反应过程中还有少量 生成,进而认为该物质对反应有催化作用,如图2所示,实验中丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
(3)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中硝酸铜的质量分数较高所致,另一部分同学认为是该溶液中溶解了通入的物质。请你设计一个实验方案来证明哪种假设正确。(写出实验操作、实验现象和结论) 。
(1)3Cu + 8H+ + 2NO3?=3Cu2+ + 2NO↑ + 4H2O (2分)
NO + NO2 + 2OH?=2NO2? + H2O(2分)
(2)Ⅰ.温度计 (2分) 温度不是速率明显加快的主要原因(2分)
Ⅱ.A(2分) Ⅲ.NO2(2分)
(3) 加热该绿色溶液,观察颜色变化(或向该绿色溶液中通入氮气,观察颜色变化或向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化)(2分)
NO + NO2 + 2OH?=2NO2? + H2O(2分)
(2)Ⅰ.温度计 (2分) 温度不是速率明显加快的主要原因(2分)
Ⅱ.A(2分) Ⅲ.NO2(2分)
(3) 加热该绿色溶液,观察颜色变化(或向该绿色溶液中通入氮气,观察颜色变化或向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化)(2分)
试题分析:(1)硝酸具有强氧化性,稀硝酸的还原产物是NO,所以图1中铜与稀硝酸反应的离子方程式为3Cu + 8H+ + 2NO3?=3Cu2+ + 2NO↑ + 4H2O。反应中液面上方的气体颜色也在不断加深,这是由于NO被氧化生成了红棕色的NO2。不论是NO还是NO2都是大气污染物,需要尾气处理,所以氢氧化钠溶液的作用是吸收NO和NO2,防止污染空气,反应的离子方程式为NO + NO2 + 2OH?=2NO2? + H2O。
(2)I、如果是因为反应放热导致溶液温度升高所致,则必须测量溶液的温度,因此完成此实验还需要的仪器是温度计。根据表中数据可知,80min内溶液的温度只上升了2℃,这说明随着反应的进行,溶液的温度变化不明显,因此温度不是速率明显加快的主要原因。
Ⅱ、为验证铜离子是否有催化作用,作对比实验,在一支试管中加入含有铜离子的盐,一支试管中不加铜盐,然后比较反应速率,根据反应速率大小确定假设是否正确。为防止阴离子对实验的干扰,最好选择硝酸铜晶体,答案选A。
Ⅲ、根据液面上方的气体颜色也在不断加深可推断反应过程中还有少量NO2生成。
(3)如果试管中溶液呈绿色,而不显蓝色。是由于NO2引起的,则可以将将绿色的混合溶液加热,若能放出红棕色气体、且溶液变蓝色,说明这个假设正确或将NO2气体通入蓝色硝酸铜溶液中观察溶液颜色是否变绿色。

练习册系列答案
相关题目

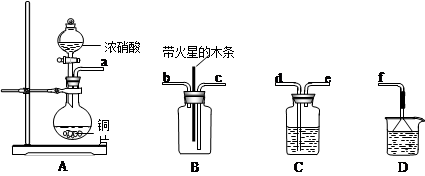

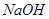 溶液的作用是________________。
溶液的作用是________________。