题目内容
标准状态下,一个容积为a ml 的烧瓶中盛满NO2气体,将其倒立于装有大量水的水槽中。向烧瓶里通入b ml 氧气,最终烧瓶顶端残留c ml 气体。
(1) 写出残留气体可能的分子式
(2)求c (用含有a、b的数学式表示)
(1) 写出残留气体可能的分子式
(2)求c (用含有a、b的数学式表示)
(本题5分)(1) O2 NO (2) c=" b" —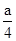 或 c =
或 c = 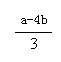
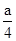 或 c =
或 c = 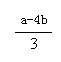
试题分析:(1)NO2和氧气溶于水反应的化学方程式是4NO2+O2 +2H2O=4HNO3,所以如果反应中气体有剩余,则可能是氧气,也可能是NO2,但剩余但NO2又能和水反应生成NO和硝酸,所以可能的气体应该是NO。
(2)如果氧气剩余,则
4NO2 + O2+2H2O=4HNO3
4ml 1ml
aml 0.25aml
所以剩余氧气的体积水bml-0.25ml
如果剩余气体是NO,则
4NO2 + O2+2H2O=4HNO3
4ml 1ml
4aml bml
剩余NO2是aml-4bml,所以根据反应的化学方程式3NO2+H2O=HNO3+NO可,生成NO是
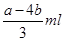 2和氧气溶于水的有关计算
2和氧气溶于水的有关计算点评:该题是中等难度的试题,试题基础性强,才能对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力,提高学生分析问题、解决问题的能力。该题的关键是理解反应的原理,然后讨论、分析、判断即可。

练习册系列答案
相关题目

 NH3↑+H2O
NH3↑+H2O