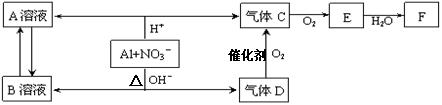
题目内容
I.下面是提纯大理石(主要杂质是氧化铁)的流程图:

按要求回答下列问题:
(1)操作Ⅱ中要随时测定pH,在实验室中用pH试纸测定溶液pH的操作是______________________________。
(2)检验Fe3+已完全生成Fe(OH)3沉淀的方法是________________________________。
(3)由滤液B得到晶体B,其主要成分是__________。
II.某化学小组在实验中用浓硝酸和铜反应制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧,其实验装置图如下:
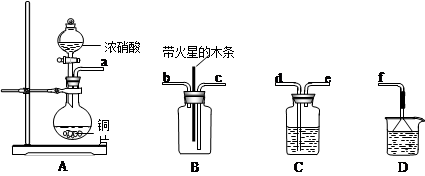
(1)按气流方向连接各仪器接口,顺序为a→______→______→______→______→f。装置C的作用________________、装置D的试剂是__________________。
(2)已知二氧化氮和碳在点燃条件下反应生成两种物质的量比为2:1的无毒气体,则该反应的化学方程式为:___________________________。

按要求回答下列问题:
(1)操作Ⅱ中要随时测定pH,在实验室中用pH试纸测定溶液pH的操作是______________________________。
(2)检验Fe3+已完全生成Fe(OH)3沉淀的方法是________________________________。
(3)由滤液B得到晶体B,其主要成分是__________。
II.某化学小组在实验中用浓硝酸和铜反应制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧,其实验装置图如下:

(1)按气流方向连接各仪器接口,顺序为a→______→______→______→______→f。装置C的作用________________、装置D的试剂是__________________。
(2)已知二氧化氮和碳在点燃条件下反应生成两种物质的量比为2:1的无毒气体,则该反应的化学方程式为:___________________________。
Ⅰ.(1)取一小块pH试纸放在玻璃片上,用玻璃棒沾取少量溶液点在pH试纸中部,变色后和比色卡对比,读出pH。(2)取上层清液(或滤液),滴加几滴KSCN溶液,如果溶液颜色不变,则说明Fe3+沉淀完全,如果变红,则说明没有沉淀完全。(有其他合理答案也可得分)。(3)NH4NO3
Ⅱ.(1)d→e→c→b;干燥气体;NaOH。(2)2NO2+2C 2CO2+N2
2CO2+N2
Ⅱ.(1)d→e→c→b;干燥气体;NaOH。(2)2NO2+2C
 2CO2+N2
2CO2+N2试题分析:(1)在实验室中用pH试纸测定溶液pH的操作是(1)取一小块pH试纸放在玻璃片上,用玻璃棒沾取少量溶液点在pH试纸中部,变色后和比色卡对比,读出pH。(2)过滤后的溶液中是否含铁,如含有,铁应以Fe3+形式存在,Fe3+遇KSCN溶液变为血红色,硫氰化钾溶液作为检验Fe3+的特征试剂,反应的离子方程式Fe3++3SCN-=Fe(SCN)3。(3)根据离子反应的情况,可以得出溶液中最后有铵根离子和硝酸根离子存在,故为NH4NO3。Ⅱ. (1)制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧首先要确保能产生二氧化氮气体并且要干燥,故连接顺序为d→e→c→b;装置C中装有浓硫酸目的是干燥气体;尾气中有二氧化氮要回收否则会污染环境,用NaOH来吸收。(2)根据无毒气体和元素守恒可以推出反应为2NO2+2C
 2CO2+N2。
2CO2+N2。
练习册系列答案
相关题目

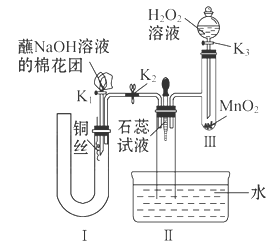
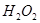 溶液中滴加少量
溶液中滴加少量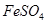 溶液,可发生如下两个反应:
溶液,可发生如下两个反应: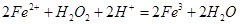 ,
, 下列说法正确的是
下列说法正确的是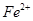 和
和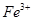 的总量保持不变
的总量保持不变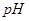 逐渐下降
逐渐下降