题目内容
【题目】碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示。
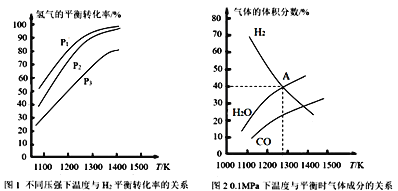
(1)该反应的平衡常数表达式为K=___。
(2)由图1可知,该反应ΔH__0(填“>”或“<”),p1、p2、p3由大到小的顺序为___。
(3)由图2可知,A点时H2的平衡转化率为___。
【答案】K= > p3>p2>p1 50%
> p3>p2>p1 50%
【解析】
(1)根据化学平衡常数的定义书写该反应的平衡常数表达式;
(2)图象中氢气体积分数随温度升高减小,说明升温平衡正向进行;MoS2(s)+4H2(g)+2Na2CO3(s)Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),反应前后气体物质的量增大,压强越大平衡逆向进行;
(3)由图可知A点时氢气的体积分数为40%,结合三行计算列式计算平衡转化率。
(1)MoS2(s)+4H2(g)+2Na2CO3(s)Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),化学平衡常数为达到平衡,体系各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,固体或纯液体没有浓度变化量,则该反应的平衡常数表达式为K= ;
;
(2)图象中氢气体积分数随温度升高减小,说明升温平衡正向进行,正反应为为吸热反应,△H>0,MoS2(s)+4H2(g)+2Na2CO3(s)Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),该反应正向是气体增大的反应,增大压强则平衡逆向进行,氢气体积分数增大,即其它条件相同时,压强越大,氢气体积分数越大,则p3>p2>p1;
(3)设生成二氧化碳物质的量为x,三段式为
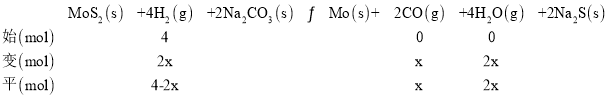
由图可知A点时氢气的体积分数为40%,得到![]() ×100%=40%,x=1mol,氢气转化率=
×100%=40%,x=1mol,氢气转化率=![]() ×100%=50%。
×100%=50%。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.宜城市鄂西化工厂以铬铁矿(主要成分为 FeO 和 Cr2O3,含有 Al2O3、SiO2 等杂质)为主要原料生产化工原料红矾钠(主要成分 Na2Cr2O7·2H2O),工艺流程如下图:
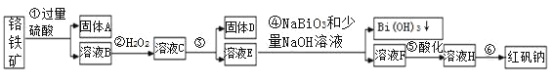
i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为 CrO42-。ii.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
(1)步骤③需加氢氧化钠溶液,此时pH要调到5的目的是__________________。
(2)写出④反应的离子方程式____________________________________。
(3)将溶液 H 经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是______________(填操作名称)。
Ⅱ.经检测鄂西化工厂的工业废水中含 5.00×10-3 mol·L-1 的 Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4(Fe 的化合价依次为+3、+2),又设计了如下工艺流程:
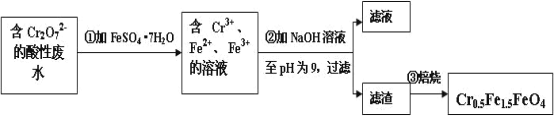
(1)第①步反应的离子方程式是_________________________________________。
(2)欲使 1L 该废水中的 Cr2O72-完全转化为 Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为_________g (已知 FeSO4·7H2O 的摩尔质量为 278 g/mol)。
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应;
②用水一乙醇液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 2.10 | 2.50 | 1.40 |
滴定后读数/mL | 22.00 | 22.50 | 21.50 |
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________________________________。
(4)气体样品中CO的体积分数为__________(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)
(5)下列操作会造成所测CO的体积分数偏大的是__________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出

