题目内容
稀硫酸与铁发生反应,生成氢气的体积为44.8L(标准状况).请计算反应生成氢气的质量和消耗的铁的物质的量.______.
标况下,44.8L氢气的物质的量=
=2mol,则m(H2)=2mol×2g/mol=4g;
由方程式Fe+H2SO4=FeSO4+H2↑可知,n(Fe)=n(H2)=2mol,
故答案为:m(H2)=4g,n(Fe)=2mol.
| 44.8L |
| 22.4L/mol |
由方程式Fe+H2SO4=FeSO4+H2↑可知,n(Fe)=n(H2)=2mol,
故答案为:m(H2)=4g,n(Fe)=2mol.

练习册系列答案
相关题目
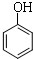 +3Br2→2
+3Br2→2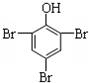 ↓
↓