题目内容
(8分)在537℃、101KPa 时,往容积可变的密闭容器中充入2mol SO2、 1mol O2,此时容器的体积为200L。向容器中加入催化剂(固体)并保持恒温恒压,发生反应:2SO2(g)+O2(g)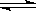 2SO3(g)达到平衡时,平衡气体中SO3的体积分数为91%。试回答下列问题:
2SO3(g)达到平衡时,平衡气体中SO3的体积分数为91%。试回答下列问题:
(1)保持上述温度和压强不变,若向容器中只充入2mol SO3并加入固体催化剂。则平衡时,SO2的体积分数是 ,容器的体积为 L。
(2)若温度和容器的容积不变,则平衡时的容器内气体的压强为 KPa。
(3)温度仍保持537℃,容器体积保持200L不变(恒容)。充入a molSO2、b molO2,并加入固体催化剂,反应达平衡时,SO3的体积分数仍为0.91,体系压强为101KPa。若a:b=2:1,则a= 。
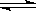 2SO3(g)达到平衡时,平衡气体中SO3的体积分数为91%。试回答下列问题:
2SO3(g)达到平衡时,平衡气体中SO3的体积分数为91%。试回答下列问题:(1)保持上述温度和压强不变,若向容器中只充入2mol SO3并加入固体催化剂。则平衡时,SO2的体积分数是 ,容器的体积为 L。
(2)若温度和容器的容积不变,则平衡时的容器内气体的压强为 KPa。
(3)温度仍保持537℃,容器体积保持200L不变(恒容)。充入a molSO2、b molO2,并加入固体催化剂,反应达平衡时,SO3的体积分数仍为0.91,体系压强为101KPa。若a:b=2:1,则a= 。
(1)60% 137(2)69(3)2.91
试题分析:(1)充入2mol SO2、 1mol O2和只充入2mol SO3是等效平衡。
2SO3(g)
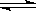 2SO2(g)+O2(g)
2SO2(g)+O2(g)始(mol) 2
变(mol) 2x 2x x
平(mol)2-2x 2x x
由三氧化硫体积分数为91%得x=18/291。二氧化硫体积分数为60%,容器体积约为137L。
(2)若温度和容器的体积不变,则压强比等于气体物质的量比。气体压强约为69KPa。
(3) 2SO2(g)+O2(g)
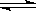 2SO3(g)
2SO3(g)始(mol) 2b b
平(mol)2b-2x b-x 2x
平衡时气体物质的量为3mol,三氧化硫体积分数为91%,所以x=1.365mol,a=2.91mol。
点评:化学平衡计算列出起始、变化、平衡各物质物质的量即可解答。

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
 CO2(g)+H2(g)
CO2(g)+H2(g)  bB(g)达平衡后,保持温度不变,,当达到新的平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,,当达到新的平衡时,B的浓度是原来的60%,则 2NH3(g),能说明反应已达到平衡状态的是:( )
2NH3(g),能说明反应已达到平衡状态的是:( )  H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是( )。
H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是( )。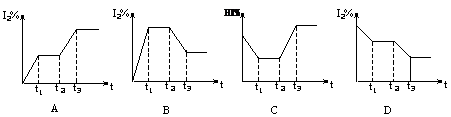
 2NH3(g),不能作为反应达到平衡状态的判断依据是( )
2NH3(g),不能作为反应达到平衡状态的判断依据是( ) C(g)达到平衡时,C的体积分数为40%。试回答有关问题。
C(g)达到平衡时,C的体积分数为40%。试回答有关问题。 N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是( )
N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是( ) bB(g)+cC(g),在温度不变的条件下,再充入一定量的A,重新达到平衡时,下列判断中正确的是
bB(g)+cC(g),在温度不变的条件下,再充入一定量的A,重新达到平衡时,下列判断中正确的是