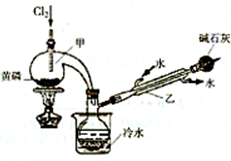
题目内容
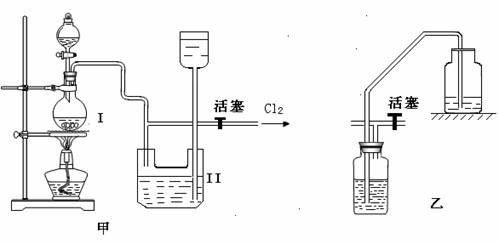
实验室制备Cl2时,反应物即使在停止加热后还会继续反应一段时间,当要收集多瓶Cl2时,常有较多的Cl2逸散.为了防止多余的Cl2逸散到空气中,并使Cl2 随时取用,有人设计了如图甲装置来制取Cl2.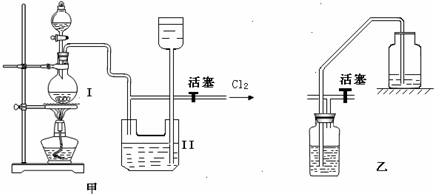
(1)甲装置Ⅱ是利用
(2)甲装置Ⅱ中盛有的液体是
(3)甲装置Ⅱ
(4)甲装置Ⅰ中反应的化学方程式为
(5)实验室多余Cl2用
分析:(1)根据装置Ⅱ储气原理和特点分析;利用甲中装置Ⅱ的作用分析储气原理,根据氯气的性质及装置Ⅱ中气体压强的变化对溶液的作用分析;
(2)根据气体的成分及气体的性质分析选取的液体;
(3)利用甲中装置Ⅱ和乙装置的作用分析;
(4)依据实验目的和装置分析是氯气的发生装置,依据二氧化锰和浓盐酸加热反应制备氯化锰、氯气和水;
(5)氯气是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,反应生成氯化钠、次氯酸钠和水;
(2)根据气体的成分及气体的性质分析选取的液体;
(3)利用甲中装置Ⅱ和乙装置的作用分析;
(4)依据实验目的和装置分析是氯气的发生装置,依据二氧化锰和浓盐酸加热反应制备氯化锰、氯气和水;
(5)氯气是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,反应生成氯化钠、次氯酸钠和水;
解答:解:(1)分析装置特征,甲中Ⅱ装置是储气装置,关闭活塞利用气体压强增大,把液体压入上方容器,达到储气目的,需要氯气时,打开活塞使装置达到随时取用Cl2的目的,
故答案为:压强差,压入上方的容器内,储存氯气;
(2)浓盐酸具有挥发性,加热更促进了浓盐酸的挥发,所以制取的氯气中含有氯化氢气体,氯化氢极易溶于水,氯气和水也反应,所以不能用水吸收氯化氢气体;饱和食盐水中含有氯离子,所以能抑制氯气和水的反应降低氯气的溶解度,故甲中Ⅱ中盛有的液体是饱和食盐水,
故答案为:饱和食盐水;
(3)甲中装置Ⅱ和乙装置都是通过排出液体贮存气体的装置,所以能代替,
故答案为:能;
(4)甲装置Ⅰ中反应是实验室制备氯气的装置,二氧化锰和浓盐酸加热反应制备氯化锰、氯气和水,反应的化学方程式为:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(5)氯气是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:NaOH溶液,Cl2+2OH-=ClO-+Cl-+H2O;
故答案为:压强差,压入上方的容器内,储存氯气;
(2)浓盐酸具有挥发性,加热更促进了浓盐酸的挥发,所以制取的氯气中含有氯化氢气体,氯化氢极易溶于水,氯气和水也反应,所以不能用水吸收氯化氢气体;饱和食盐水中含有氯离子,所以能抑制氯气和水的反应降低氯气的溶解度,故甲中Ⅱ中盛有的液体是饱和食盐水,
故答案为:饱和食盐水;
(3)甲中装置Ⅱ和乙装置都是通过排出液体贮存气体的装置,所以能代替,
故答案为:能;
(4)甲装置Ⅰ中反应是实验室制备氯气的装置,二氧化锰和浓盐酸加热反应制备氯化锰、氯气和水,反应的化学方程式为:
MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
(5)氯气是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:NaOH溶液,Cl2+2OH-=ClO-+Cl-+H2O;
点评:本题考查了实验室制备氯气的原理分析应用,装置特征的理解和制备方法,主要是储气装置的原理分析,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
实验室制备Cl2,可以用下列三种方法:
①MnO2+4HCl(C)
MnCl2+Cl2↑+2H2O
②2KMnO4+16HCl(C)=2KCl+2MnCl2+5Cl2↑+8H2O
③KClO3+6HCl(C)=KCl+3Cl2↑+3H2O
如果分别用上述三种方法制得相同体积的Cl2,下列描述正确的是( )
①MnO2+4HCl(C)
| ||
②2KMnO4+16HCl(C)=2KCl+2MnCl2+5Cl2↑+8H2O
③KClO3+6HCl(C)=KCl+3Cl2↑+3H2O
如果分别用上述三种方法制得相同体积的Cl2,下列描述正确的是( )
| A、同温同压下制得相同体积的Cl2时,三个反应中被氧化的HCl的物质的量相同 |
| B、同温同压下制得相同体积的Cl2时,三个反应中电子转移的总数相等 |
| C、同温同压下制得相同体积的Cl2时,三个反应中消耗的氧化剂的物质的量相同 |
| D、同温同压下制得相同体积的Cl2时,三个反应中被氧化的氯原子数不同 |