题目内容
【题目】化学反应伴随能量变化,其中能量的主要形式是热能。
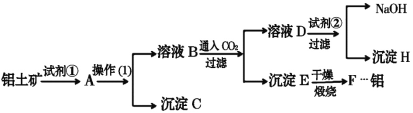
I:如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,往试管中放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
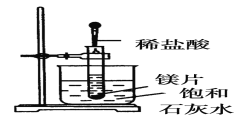
(1)实验中观察到的现象是________________________。
(2)产生上述现象的原因是________________________。
(3)写出有关反应的离子方程式__________________________。
(4)由实验推知,MgCl2和H2的总能量________(填“大于”“小于”或“等于”)镁片和HCl的总能量。
II:从能量变化的角度研究反应:2H2+O2=2H2O。
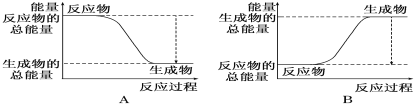
(1)如图能正确表示该反应中能量变化的是_________。
(2)已知断开或形成1 mol化学键吸收或放出的能量,叫做该化学键的键能,单位为kJ·mol-1。一些键能数据如下表:
化学键 | H—H | O=O | H—O |
键能(kJ·mol-1) | 436 | 496 | 463 |
请回答:
断裂反应物2 mol H2和1 mol O2的化学键,需要_______的总能量为______kJ;形成生成物2 mol H2 O的化学键,需要______的总能量为______kJ。所以该反应能量变化值的大小 ____________ kJ(填数值)。
【答案】镁片逐渐溶解,有大量气泡产生,烧杯中溶液变浑浊 镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体 Mg+2H+=Mg2++H2↑ 小于 A 吸收 1368 放出 1852 484
【解析】
Ⅰ.试管放入盛有25℃饱和澄清石灰水的烧杯中,往试管中放入几小块镁片,再用滴管滴入5mL盐酸于试管中,镁是活泼金属,可与酸发生反应,反应放热,由于Ca(OH)2的溶解度随温度的升高而降低,因此随着反应的进行会有Ca(OH)2析出,从而饱和石灰水变浑浊,据此分析解答;
Ⅱ.(1)反应物的总能量大于生成物的总能量时,反应为放热反应,反应物的总能量小于生成物的总能量时,反应为吸热反应,氢气与氧气反应生成水为放热反应,据此分析解答;
(2)1molH2中含有1molH—H键,1molO2中含有1molO—O键,1molH2O含有2molH—O键,结合键能数据进行计算。
Ⅰ.(1)镁与稀盐酸会发生反应:Mg+2HCl=MgCl2+H2↑,该反应为放热反应,因Ca(OH)2溶解度随温度升高而降低,故实验现象为:镁片上有大量气泡产生,镁片逐渐溶解,烧杯中溶液变浑浊,故答案为:镁片上有大量气泡产生,镁片逐渐溶解,烧杯中溶液变浑浊;
(2)由(1)分析可知,产生上述现象的原因是:镁与盐酸反应生成氢气,且该反应放热,Ca(OH)2的溶解度随温度升高而减小,故有固体析出,故答案为:镁与盐酸反应生成氢气,且该反应放热,Ca(OH)2的溶解度随温度升高而减小,故有固体析出;
(3)镁与盐酸反应的离子方程式为:Mg+2H+=Mg2++H2↑,故答案为:Mg+2H+=Mg2++H2↑;
(4)该反应为放热反应,即反应物总能量高于生成物总能量,故MgCl2溶液和H2的总能量小于镁片和盐酸的总能量,故答案为:小于;
Ⅱ.(1)氢气燃烧是放热反应,这说明反应物的总能量高于生成物的总能量,因此能正确表示该反应中能量变化的是A,故答案为:A;
(2)由于断键吸收能量,则拆开2molH2化学键需要吸收2mol×436kJ/mol=872kJ,拆开1molO2化学键需要吸收能量是1mol×496kJ/mol=496kJ,则断键共需要吸收的能量是872kJ+496kJ=1368kJ;形成4molH-O键放出的能量是4mol×463kJ/mol=1852kJ,所以2mol氢气反应最终放出的能量是1852kJ-1368kJ=484kJ,故答案为:吸收;1368;放出;1852;484。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案