题目内容
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu:相对原子质量为64)。
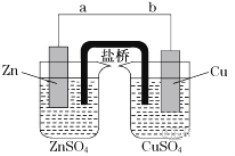
按照实验步骤依次回答下列问题:
(1)导线中电子移动方向为___(用a、b表示)。
(2)原电池的正极为__。
(3)写出装置中铜电极上的电极反应式:___。
(4)若装置中铜电极的质量增加32g,则导线中转移的电子数目为__。
(5)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,盐桥中的K+向__(填“左侧”或“右侧”)烧杯移动。
【答案】a→b Cu Cu2++2e-=Cu NA 右侧
【解析】
Zn作负极,失电子,电极反应为:Zn-2e-=Zn2+,Cu作正极,Cu2+在正极得电子,电极反应为:Cu2++2e-=Cu。
(1)电子移动方向:负极→导线→正极,即a→b,故答案为:a→b;
(2)由分析可知,正极为Cu,故答案为:Cu;
(3)Cu作正极,正极发生的反应为:Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(4)n(Cu)=![]() =0.5mol,由Cu2++2e-=Cu可知,转移电子物质的量n=2×0.5mol=1mol,即转移电子数目为NA,故答案为:NA;
=0.5mol,由Cu2++2e-=Cu可知,转移电子物质的量n=2×0.5mol=1mol,即转移电子数目为NA,故答案为:NA;
(5)K+是阳离子,阳离子向正极移动,即向右移动,故答案为:右侧。

 阅读快车系列答案
阅读快车系列答案【题目】下图是对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图像,依据图像推出盐酸和NaOH溶液的物质的量浓度是下表内各组中的
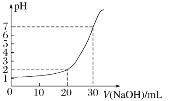
选项 溶液 | A | B | C | D |
C(HCl)/mol·L-1 | 0.12 | 0.04 | 0.03 | 0.09 |
c(NaOH)/mol·L- | 0.04 | 0.12 | 0.09 | 0.03 |
A. AB. BC. CD. D
【题目】用如图中装置进行实验,实验一段时间后,现象与预测不一致的是
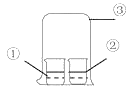
①中物质 | ②中物质 | 实验预测 | |
A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
A. AB. BC. CD. D
【题目】化学反应伴随能量变化,其中能量的主要形式是热能。
I:如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,往试管中放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
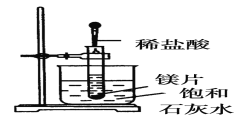
(1)实验中观察到的现象是________________________。
(2)产生上述现象的原因是________________________。
(3)写出有关反应的离子方程式__________________________。
(4)由实验推知,MgCl2和H2的总能量________(填“大于”“小于”或“等于”)镁片和HCl的总能量。
II:从能量变化的角度研究反应:2H2+O2=2H2O。
(1)如图能正确表示该反应中能量变化的是_________。
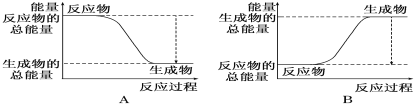
(2)已知断开或形成1 mol化学键吸收或放出的能量,叫做该化学键的键能,单位为kJ·mol-1。一些键能数据如下表:
化学键 | H—H | O=O | H—O |
键能(kJ·mol-1) | 436 | 496 | 463 |
请回答:
断裂反应物2 mol H2和1 mol O2的化学键,需要_______的总能量为______kJ;形成生成物2 mol H2 O的化学键,需要______的总能量为______kJ。所以该反应能量变化值的大小 ____________ kJ(填数值)。