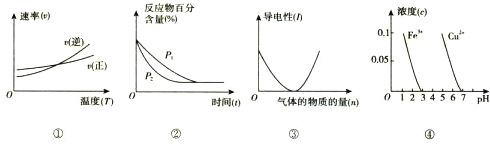
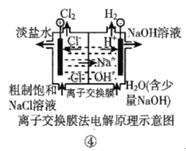
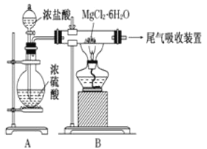
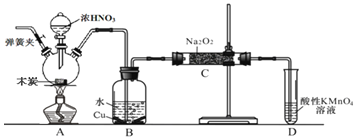
题目内容
【题目】某废水中含有Cr2O72-,为了处理有毒的Cr2O72-,需要先测定其浓度:取20 mL废水,加入适量稀硫酸,再加入过量的V1 mL c1 mol·L-1(NH4)2Fe(SO4)2溶液,充分反应(还原产物为Cr3+)。用c2 mol·L-1 KMnO4溶液滴定过量的Fe2+至终点,消耗KMnO4溶液V2 mL。则原废水中c(Cr2O72-)为(用代数式表示)( )
A. ![]() mol·L-1B.
mol·L-1B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
【答案】A
【解析】
根据电子得失守恒计算,Fe2+失去电子的物质的量等于Cr2O72-和KMnO4得到电子的物质的量之和。
Fe2+Fe3+ ,失去电子c1mol/L×V1×103L×1×(32)=c1V1×103mol,
KMnO4Mn2+,得到电子c2mol/L×V2×103L×1×(72)=5c2V2×103mol,
Cr2O722Cr3+,得到电子c(Cr2O72)×20×103L×2×(63)mol
根据得失电子守恒可得c1V1×103mol =5c2V2×103mol + c(Cr2O72)×20×103L×2×(63),解得c(Cr2O72)=![]() mol/L;
mol/L;
故选A。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目