题目内容
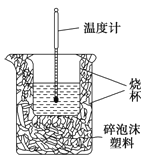
【题目】Ⅰ. 实验室利用如右图装置进行中和热的测定。回答下列问题:
(1)该图中有一处未画出,它是_____________(填仪器名称)。
(2)某同学利用50 mL 0.50 mol/L的稀盐酸与50 mL 0.55 mol/L的稀氢氧化钠溶液进行实验,最终测得中和热△H=-55.2kJ/mol。已知标准中和热为△H=-57.3kJ/mol,导致这一偏差的原因最不可能的是________(填字母序号)。
a.实验装置保温、隔热效果差
b.在量取盐酸溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度
Ⅱ. 某同学用0.1000mol·L-1的标准NaOH溶液滴定未知浓度的醋酸,其操作为如下几步。请回答:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线下,并记下读数4.60mL
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
(1)以上步骤有一步错误,该错误操作会导致测定结果_______(填“偏大”“偏小”或“不变”)
(2)如下图1是某次滴定时滴定管中的终点液面,则该次测得的醋酸物质的量浓度为_____
(3)如下图2所示为滴定图象,a、b、c、d四点中,水的电离程度最大的是 ______点。
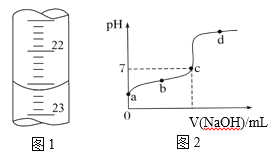
【答案】环形玻璃搅拌棒 b 偏大 0.09mol/L c
【解析】
I.(1)根据量热计的构造来判断该装置中缺少的仪器;
(2)根据中和热测定实验成败的关键是保温工作,必须确保热量不散失;
II.(1)根据碱式滴定管在装液前应用所装液体进行润洗;根据c(待测)= 分析不当操作对V(标准)的影响,以此判断浓度的误差;
分析不当操作对V(标准)的影响,以此判断浓度的误差;
(2)根据酸碱恰好中和时二者的物质的量相等计算待测醋酸物质的量浓度;
(3)酸、碱会抑制水的电离,溶液中c(H+)或c(OH-)越大,对水电离的抑制作用就越强。
(1)由量热计的构造可知该装置中缺少的仪器是环形玻璃搅拌棒;
(2) a.实验装置保温、隔热效果差,导致产生等量的水,反应放出的热量使温度计升高的温度少,因此最终使实验测得中和热数值低于标准值,a正确;
b.进行中和热测定以不足量的HCl为标准计算,若在量取盐酸溶液的体积时仰视读数,则量取的HCl的体积偏大,反应放出的热量增多,会导致测定值大于标准值,b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,会导致热量损失过多,最终使中和热测定值小于标准值,c正确;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度,一部分NaOH与盐酸直接反应,HCl的起始温度高,则反应放出的热量使温度计升高的温度偏少,以此温度差为标准计算的中和热数值偏低,d正确;
故合理选项是b;
II.(1)盛装标准碱溶液的碱式滴定管在装液前应用所装标准液体进行润洗,用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上,碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)= ,可知c(待测)偏大;
,可知c(待测)偏大;
(2)用NaOH溶液滴定醋酸,发生反应:CH3COOH+NaOH=CH3COONa+H2O,n(CH3COOH)=n(NaOH),根据滴定管刻度数值可知,滴定达到终点时读数为22.60mL,反应消耗NaOH溶液的体积V(NaOH)=22.60mL-4.60mL=18.00mL,由于c(NaOH)= 0.1000mol/L, V(CH3COOH)=20.00mL,所以c(CH3COOH)= =
=![]() mol/L=0.09mol/L;
mol/L=0.09mol/L;
(3)水是一种极弱的电解质,存在电离平衡:H2O![]() H++OH-,向水中加入酸、碱会抑制水的电离,溶液中c(H+)或c(OH-)越大,对水电离的抑制作用就越强,在该滴定中,开始是醋酸溶液,随着NaOH的滴入,溶液的酸性逐渐减弱,溶液中c(H+)逐渐减小,水的电离程度逐渐增大,当二者反应,反应pH=7时,水的电离不受到抑制,水电离达到最大值,后继续滴入NaOH溶液,碱过量,c(OH-)增大,水电离由受到抑制作用,水的电离程度又逐渐减小,因此在溶液pH=7的c点,水电离程度最大。即滴定图象的a、b、c、d四点中,水的电离程度最大的是c点。
H++OH-,向水中加入酸、碱会抑制水的电离,溶液中c(H+)或c(OH-)越大,对水电离的抑制作用就越强,在该滴定中,开始是醋酸溶液,随着NaOH的滴入,溶液的酸性逐渐减弱,溶液中c(H+)逐渐减小,水的电离程度逐渐增大,当二者反应,反应pH=7时,水的电离不受到抑制,水电离达到最大值,后继续滴入NaOH溶液,碱过量,c(OH-)增大,水电离由受到抑制作用,水的电离程度又逐渐减小,因此在溶液pH=7的c点,水电离程度最大。即滴定图象的a、b、c、d四点中,水的电离程度最大的是c点。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】(1)用O2将HCl转化为Cl2,可提高效益,减少污染.传统上该转化通过如图所示的催化剂循环实现,其中,反应①为 2HCl(g)+CuO(s)=H2O(g)+CuCl2(s) ![]() 反应②生成1molCl2(g)的反应热为
反应②生成1molCl2(g)的反应热为![]() ,则总反应的热化学方程式为_______________(反应热△H用含
,则总反应的热化学方程式为_______________(反应热△H用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
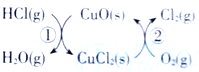
(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①该反应的![]() ____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
②100℃时达平衡后,改变反应温度为![]() ,c(N2O4)以0.0020 mol·L
,c(N2O4)以0.0020 mol·L![]() ·s
·s![]() 的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
③计算温度T时反应的平衡常数K___________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向___________(填“正反应”或“逆反应”)方向移动,N2O4的转化率______(填“增大”或“减小”)。
时间(s) | 0 | 20 | 40 | 60 | 80 |
N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |