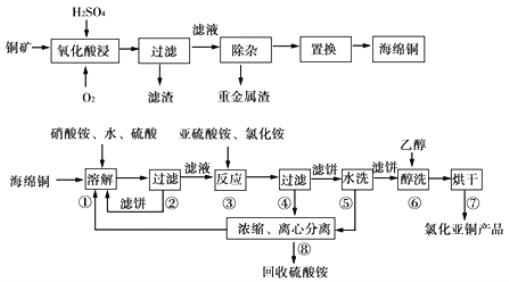
题目内容
【题目】短周期五种元素A、B、C、D、E的原子序数依次增大。A、B、C的单质在常温下都呈气态,C原子最外层电子数是电子层数的3倍,C和E位于同主族。1molDAx与足量的A2C反应生成44.8L(标准状况)G气体。A、B的单质依次为G、T,在密闭容器中充入一定量的G、T,一定条件下发生反应G+T→W(未配平),测得各物质的浓度如表所示。
物质 | T | G | W |
10min时,c/(mol/L) | 0.5 | 0.8 | 0.2 |
20min时,c/(mol/L) | 0.3 | 0.2 | 0.6 |
回答下列问题:
(1)A、B、C能组成既含离子键又含共价键的化合物,该化合物的化学式为_________。
(2)B、C、D、E的简单离子中,离子半径由大到小排序为__________。(用离子符号表示)
(3)J、L是由A、B、C、E四种元素组成的两种常见酸式盐,J、L混合可产生有刺激性气味的气体,写出这两种溶液发生反应的离子方程式_______;J、L中能使酸性高锰酸钾溶液退色的是_______(填化学式)。
(4)B2A4-C2碱性燃料电池放电效率高。该电池放电时生成B2和A2C,正极反应式为_____;电池工作一段时间后,电解质溶液的pH_____(填“增大”“减小”或“不变”)。
(5)由A、B、C、D四种元素组成的单质、化合物在一定条件下的转化关系(部分条件和产物已省略)如图所示,已知M耐高温。

①X的电子式为______;W的结构式为________。
②已知W与乙反应生成K和甲是某重要化工生产步骤之一,提高其反应速率的方法除增大反应物浓度、增大压强外,还有______、______。
【答案】NH4NO3或NH4NO2 S2->N3->O2->Mg2+ H++HSO3-=H2O+SO2↑ NH4HSO3 O2+H2O+4e-=4OH- 减小 ![]()
![]() 升高温度 加入催化剂
升高温度 加入催化剂
【解析】
C原子最外层电子数是电子层数的3倍,可推知C为O元素;短周期五种元素A、B、C、D、E的原子序数依次增大。A、B、C的单质在常温下都呈气态,可中A是H元素;B是N元素;C和E位于同主族,则E是S元素;D原子序数大于O,小于S,A2C是H2O,1molDAx与足量的A2C反应生成44.8L(标准状况)G气体,n(G)=44.8L÷22.4L/mol=2mol,说明G是H2,D为+2价的Mg元素。然后根据物质的性质分析推断,进行解答。
根据上述分析可知A是H元素,B是N元素,C是O元素,D是Mg元素,E是S元素。
(1) A、B、C三种元素分别是H、N、O,三种元素能组成既含离子键又含共价键的化合物,该化合物可能为NH4NO3、NH4NO2;
(2)B、C、D、E元素分别是N、O、Mg、S,离子核外电子层数越多,离子半径越大;对于电子层数相同的元素,离子的核电荷数越大,离子半径越小;S2-核外有3个电子层,N3-、O2-、Mg2+离子核外有2个电子层,所以四种元素形成的简单离子中,离子半径由大到小排序为S2->N3->O2->Mg2+;
(3)J、L是由A、B、C、E四种元素组成的两种常见酸式盐,则这两种盐为NH4HSO3、NH4HSO4,硫酸氢铵是强酸的酸式盐,在溶液中以H+形式存在,亚硫酸氢铵是弱酸的酸式盐J、L混合可产生有刺激性气味的气体,这两种溶液发生反应的离子方程式H++HSO3-=H2O+SO2↑;J、L中,NH4HSO3中的S为+4价,具有还原性,能被具有强氧化性的高锰酸钾溶液氧化,因此能使酸性高锰酸钾溶液退色的是NH4HSO3;
(4)B2A4是N2H4,C2是O2,在碱性环境中该燃料电池放电效率高。该电池放电时生成N2和H2O,在正极上O2获得电子,发生还原反应变为OH-,正极的反应式为O2+H2O+4e-=4OH-;在负极上N2H4失去电子,与溶液中的OH-结合形成N2和H2O,电极反应式为:N2H4-4e-+4 OH-=N2+4H2O,总反应方程式为:N2H4+O2=N2+2H2O,可见电池工作一段时间后,电解质溶液中溶质的物质的量不变,但由于溶液的体积增大,所以溶液的pH减小;
(5)由A、B、C、D四种元素组成的单质、化合物已知M耐高温,说明M是离子化合物,结合这几种物质的转化关系及物质的性质可知X是Mg3N2,Y是Mg(OH)2;M是MgO;W是NH3;甲是H2O,乙是O2;K是NO;F是NO2。
①X是Mg3N2,Mg3N2是离子化合物,其电子式为![]() ;W为NH3,在该分子中,N原子与3个H原子形成3个共价键,结构式为
;W为NH3,在该分子中,N原子与3个H原子形成3个共价键,结构式为![]() ;
;
②NH3与O2在催化剂存在条件下,加热发生氧化反应,产生NO和水,该反应是工业上制取硝酸的重要化学反应,反应方程式为4NH3+5O2![]() 4NO+6H2O,根据一些化学反应速率的因素,要提高该反应速率,除了可以增大反应物浓度、增大压强外,还有升高温度、使用合适的催化剂。
4NO+6H2O,根据一些化学反应速率的因素,要提高该反应速率,除了可以增大反应物浓度、增大压强外,还有升高温度、使用合适的催化剂。

【题目】一定温度下,在三个体积均为1.0L的恒容密闭容器中,充入一定量的A和B分别发生下列反应:3A(g)+B(g)![]() 2C(g)+D(g)+E(s),下列说法正确的是
2C(g)+D(g)+E(s),下列说法正确的是
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
A | B | A | B | ||
容器Ⅰ | 300 | 3 | 1 | 0.8 | |
容器Ⅱ | 300 | 6 | 2 | ||
容器Ⅲ | 240 | 3 | 1 | 0.4 | |
A. 该反应正反应为吸热反应
B. 反应达到平衡后加入2molE,A的转化率减小
C. 容器Ⅱ达到平衡时B的转化率比容器I大
D. 240℃ 时,该反应的平衡常数K=1.25
【题目】某市场销售的食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生反应的化学方程式为:_______________________。
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是 ____________________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_______________________。
②b中反应所产生的I2的物质的量是____________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是__________________ mg/kg。(以含w的代数式表示)