МвДҝДЪИЭ
¶юСх»ҜБтКЗЦШТӘөД№ӨТөФӯБП,МҪҫҝЖдЦЖұё·Ҫ·ЁәНРФЦКҫЯУР·ЗіЈЦШТӘөДТвТеЎЈ
(1)№ӨТөЙПУГ»ЖМъҝу(FeS2,ЖдЦРSФӘЛШОӘ-lјЫ)ФЪёЯОВПВәНСхЖш·ҙУҰЦЖұёSO2:4FeS2+11O2 8SO2+2Fe2O3,ёГ·ҙУҰЦРұ»Сх»ҜөДФӘЛШКЗЎЎЎЎЎЎЎЎ(МоФӘЛШ·ыәЕ)ЎЈөұёГ·ҙУҰЧӘТЖ2.75 molөзЧУКұ,ЙъіЙөД¶юСх»ҜБтФЪұкЧјЧҙҝцПВөДМе»эОӘЎЎЎЎЎЎЎЎLЎЈ
8SO2+2Fe2O3,ёГ·ҙУҰЦРұ»Сх»ҜөДФӘЛШКЗЎЎЎЎЎЎЎЎ(МоФӘЛШ·ыәЕ)ЎЈөұёГ·ҙУҰЧӘТЖ2.75 molөзЧУКұ,ЙъіЙөД¶юСх»ҜБтФЪұкЧјЧҙҝцПВөДМе»эОӘЎЎЎЎЎЎЎЎLЎЈ
(2)КөСйКТЦРУГПВБРЧ°ЦГІв¶ЁSO2ҙЯ»ҜСх»ҜОӘSO3өДЧӘ»ҜВКЎЈ(ТСЦӘSO3ИЫөгОӘ16.8 Ўж,јЩЙиЖшМеҪшИлЧ°ЦГКұ·Цұрұ»НкИ«ОьКХ,ЗТәцВФҝХЖшЦРCO2өДУ°ПмЎЈ)
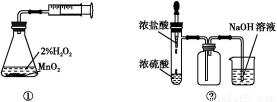
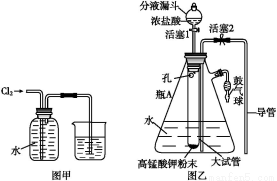
ўЩјтКцК№УГ·ЦТәВ©¶·ПтФІөЧЙХЖҝЦРөОјУЕЁБтЛбөДІЩЧчКЗ ЎЈ
ўЪКөСй№эіМЦР,РиТӘНЁИлСхЖшЎЈКФРҙіцТ»ёцУГИзНјЛщКҫЧ°ЦГЦЖИЎСхЖшөД»ҜС§·ҪіМКҪ ЎЈ
ўЫөұНЈЦ№НЁИлSO2,ПЁГрҫЖҫ«өЖәу,РиТӘјМРшНЁТ»¶ОКұјдөДСхЖш,ЖдДҝөДКЗ ЎЈ
ўЬКөСйҪбКшәу,ИфЧ°ЦГDФцјУөДЦКБҝОӘm g,Ч°ЦГEЦРІъЙъ°ЧЙ«іБөнөДЦКБҝОӘn g,ФтҙЛМхјюПВ¶юСх»ҜБтөДЧӘ»ҜВККЗЎЎЎЎЎЎЎЎ(УГә¬ЧЦДёөДҙъКэКҪұнКҫ,І»УГ»Ҝјт)ЎЈ
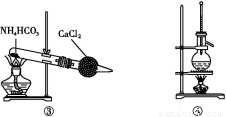
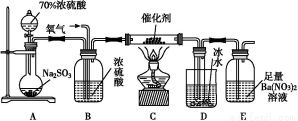
(3)ДіС§П°РЎЧйЙијЖУГИзНјЧ°ЦГСйЦӨ¶юСх»ҜБтөД»ҜС§РФЦКЎЈ
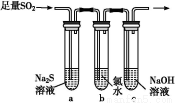
ўЩДЬЛөГч¶юСх»ҜБтҫЯУРСх»ҜРФөДКөСйПЦПуОӘ ЎЈ
ўЪОӘСйЦӨ¶юСх»ҜБтөД»№ФӯРФ,ід·Ц·ҙУҰәу,ИЎКФ№ЬbЦРөДИЬТә·ЦіЙИэ·Э,·ЦұрҪшРРИзПВКөСй:
·Ҫ°ёўс:ПтөЪТ»·ЭИЬТәЦРјУИлAgNO3ИЬТә,УР°ЧЙ«іБөнЙъіЙ
·Ҫ°ёўт:ПтөЪ¶ю·ЭИЬТәјУИлЖ·әмИЬТә,әмЙ«НКИҘ
·Ҫ°ёўу:ПтөЪИэ·ЭИЬТәјУИлBaCl2ИЬТә,ІъЙъ°ЧЙ«іБөн
ЙПКц·Ҫ°ёЦРәПАнөДКЗЎЎЎЎЎЎЎЎ(МоЎ°ўсЎұЎўЎ°ўтЎұ»тЎ°ўуЎұ);КФ№ЬbЦР·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪОӘ ЎЈ
ўЫөұНЁИл¶юСх»ҜБтЦБКФ№ЬcЦРИЬТәПФЦРРФКұ,ёГИЬТәЦРc(Na+)=ЎЎЎЎЎЎЎЎ(УГә¬БтОўБЈЕЁ¶ИөДҙъКэКҪұнКҫ)ЎЈ
(1)SЎўFeЎЎ11.2
(2)ўЩҙтҝӘ·ЦТәВ©¶·ЙПөД»оИы,РэҝӘ·ЦТәВ©¶·өДРэИы,»әВэөОјУЎЈ
ўЪ2KMnO4 K2MnO4+MnO2+O2Ўь»т2KClO3
K2MnO4+MnO2+O2Ўь»т2KClO3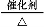 2KCl+3O2Ўь
2KCl+3O2Ўь
ўЫК№ІРБфФЪЧ°ЦГЦРөД¶юСх»ҜБтәНИэСх»ҜБтұ»ід·ЦОьКХ
ўЬ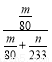 ЎБ100%
ЎБ100%
(3)ўЩaКФ№ЬЦРУРөӯ»ЖЙ«іБөнЙъіЙ
ўЪўуЎЎCl2+SO2+2H2O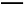 4H++2Cl-+S
4H++2Cl-+S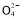
ўЫ2c(S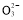 )+c(HS
)+c(HS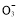 )
)
ЎҫҪвОцЎҝ(1)4FeS2+11O2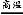 8SO2+2Fe2O3,ёГ·ҙУҰЦРұ»Сх»ҜөДФӘЛШКЗSЎўFe;ЙиЙъіЙ¶юСх»ҜБтөДМе»эКЗx LЎЈ
8SO2+2Fe2O3,ёГ·ҙУҰЦРұ»Сх»ҜөДФӘЛШКЗSЎўFe;ЙиЙъіЙ¶юСх»ҜБтөДМе»эКЗx LЎЈ
4FeS2+11O2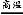 8SO2 +2Fe2O3ЎЎЧӘТЖөзЧУ
8SO2 +2Fe2O3ЎЎЧӘТЖөзЧУ
179.2 L 44 mol
x L 2.75 mol
x=11.2ЎЈ
(2)ўЩҙтҝӘ·ЦТәВ©¶·ЙПөД»оИы,РэҝӘ·ЦТәВ©¶·өДРэИы,»әВэөОјУЎЈ
ўЪјУИИKMnO4№ММе»тKClO3әНMnO2өД№ММе»мәПОп;
ўЫК№ІРБфФЪЧ°ЦГЦРөДSO2әНSO3ұ»ід·ЦОьКХЎЈ
ўЬФЪұщЛ®ЧҙМ¬ПВ,SO3іК№ММ¬,ЛщТФЧ°ЦГDФцјУөДЦКБҝјҙОӘSO3өДЦКБҝ,n(SO3)=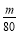 mol,Ч°ЦГEУЙУЪОьКХБЛSO2¶шЙъіЙBaSO4°ЧЙ«іБөн,n(SO2)=n(BaSO4)=
mol,Ч°ЦГEУЙУЪОьКХБЛSO2¶шЙъіЙBaSO4°ЧЙ«іБөн,n(SO2)=n(BaSO4)=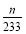 mol,УЙ2SO2+O2
mol,УЙ2SO2+O2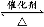 2SO3ЦӘ,ёГ·ҙУҰПыәДөфөДn(SO2)=n(SO3)=
2SO3ЦӘ,ёГ·ҙУҰПыәДөфөДn(SO2)=n(SO3)= 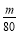 mol,ЛщТФ¶юСх»ҜБтөДЧӘ»ҜВКОӘ:
mol,ЛщТФ¶юСх»ҜБтөДЧӘ»ҜВКОӘ: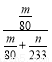 ЎБ100%ЎЈ
ЎБ100%ЎЈ
(3)ўЩNa2SәНSO2·ўЙъСх»Ҝ»№Фӯ·ҙУҰЙъіЙөҘЦКБтіБөнЎЈ
ўЪўуәПАн,ТтОӘёГ°ЧЙ«іБөнОӘBaSO4,АҙФҙҫНКЗSO2ұ»Сх»Ҝ;¶ш·Ҫ°ёўс:°ЧЙ«іБөнОӘAgCl,УлSO2өД»№ФӯРФОЮ№Ш;·Ҫ°ёўтСйЦӨөДКЗSO2өДЖҜ°ЧРФЎЈ
ўЫёщҫЭөзәЙКШәг:c(Na+)+c(H+)=c(OH-)+2c(S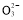 )+c(HS
)+c(HS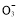 ),УЦИЬТәПФЦРРФ,c(H+)=c(OH-),ЛщТФc(Na+)=2c(S
),УЦИЬТәПФЦРРФ,c(H+)=c(OH-),ЛщТФc(Na+)=2c(S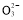 )+c(HS
)+c(HS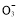 )ЎЈ
)ЎЈ

 ГыРЈҝОМГПөБРҙр°ё
ГыРЈҝОМГПөБРҙр°ёТСЦӘ25 ЎжКұУР№ШИхЛбөДөзАлЖҪәвіЈКэИзПВұн:
ИхЛбөД»ҜС§КҪ | CH3COOH | HCN | H2CO3 |
өзАлЖҪәвіЈКэ(25 Ўж) | 1.8ЎБ10-5 | 4.9ЎБ10-10 | K1=4.3ЎБ10-7 K2=5.6ЎБ10-11 |
ФтПВБРУР№ШЛө·ЁХэИ·өДКЗ(ЎЎЎЎ)
A.өИЕЁ¶ИөДёчИЬТәpH№ШПөОӘ:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a molЎӨL-1 HCNИЬТәУлb molЎӨL-1 NaOHИЬТәөИМе»э»мәП,ЛщөГИЬТәЦРc(Na+)>c(CN-),ФтaТ»¶ЁРЎУЪb
C.ұщҙЧЛбЦРЦрөОјУЛ®,ФтИЬТәөДөјөзРФЎўҙЧЛбөДөзАліМ¶ИЎўpHҫщПИФцҙуәујхРЎ
D.NaHCO3әНNa2CO3»мәПИЬТәЦР,Т»¶ЁУРc(Na+)+c(H+)=c(OH-)+c(HC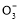 )+2c(C
)+2c(C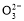 )
)