题目内容
可逆反应达到平衡的重要特征是( )
| A.反应停止了 | B.正、逆反应的速率相等 |
| C.正、逆反应都还在进行 | D.正、逆反应的速率均为零 |
B
试题分析:逆反应达到平衡的重要特征是:正、逆反应速率相等,即:v(正) = v(逆)。B选项正确。 v(正) = v(逆) ≠0,故A、D两选项错误。可逆反应一旦发生,不论平衡与不平衡,正、逆反应都在进行。故 C选项错误。 所以选B。
点评:本题考了化学平衡状态建立及化学平衡状态的特征。了解“逆,等,动,定,变”是化学平衡状态的特征。即可顺利完成此类题目。

练习册系列答案
相关题目
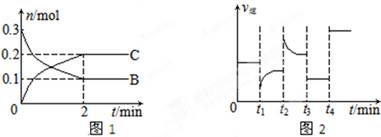
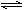 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )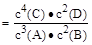
 3C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.25 mol/L。下列判断中正确的是( )
3C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.25 mol/L。下列判断中正确的是( ) CO2(g) + H2(g), 若反应达平衡时测得CO转化率为40%,则
CO2(g) + H2(g), 若反应达平衡时测得CO转化率为40%,则 cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是 ( )
cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是 ( ) (2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
(2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)  2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。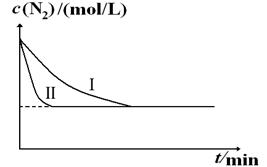
 2AB(g) 在一定条件下,达到平衡状态的标志是( )
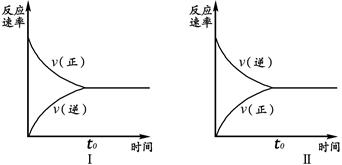
2AB(g) 在一定条件下,达到平衡状态的标志是( ) 2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示: