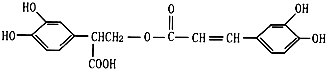题目内容
常温下,pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化).下列说法正确的是( )
| A、原醋酸物质的量浓度大于0.01mol?L-1 |
| B、两种反应物中水电离出的c(H+)都是1×10-12mol?L-1 |
| C、反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.01mol?L-1 |
| D、反应后的溶液中:c(CH3COO-)=c(Na+)>c(H+)=c( OH-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.醋酸为弱电解质,溶液中部分电离出氢离子,pH=2的醋酸溶液中氢离子浓度为0.01mol/L,则溶液中醋酸浓度大于0.01mol/L;
B.酸溶液和碱溶液都抑制了水的电离,氢离子、氢氧根离子浓度相等,则溶液中水的电离程度相等;
C.醋酸为弱电解质,溶液中只能部分电离,题中数据无法计算溶质醋酸的物质的量;
D.反应的溶液为醋酸钠溶液,醋酸根离子水解,溶液显示碱性,则c(H+)<c( OH-),根据电荷守恒可知:c(CH3COO-)<c(Na+).
B.酸溶液和碱溶液都抑制了水的电离,氢离子、氢氧根离子浓度相等,则溶液中水的电离程度相等;
C.醋酸为弱电解质,溶液中只能部分电离,题中数据无法计算溶质醋酸的物质的量;
D.反应的溶液为醋酸钠溶液,醋酸根离子水解,溶液显示碱性,则c(H+)<c( OH-),根据电荷守恒可知:c(CH3COO-)<c(Na+).
解答:
解:A.醋酸为弱酸,溶液中只能部分电离出氢离子,pH=2的醋酸中氢离子浓度为0.01mol/l,则溶液中醋酸的浓度大于0.01mol?L-1,故A正确;
B.pH=12的NaOH溶液中水电离的氢离子为溶液中的氢离子浓度:1×10-12mol/L,pH=2的醋酸溶液中,水电离的氢离子为溶液中的氢氧根离子浓度:1×10-12mol/L,所以两溶液中水电离的c(H+)=1×10-12mol?L-1,故B正确;
C.由于醋酸为弱电解质,溶液中氢离子浓度为0.01mol/L,则醋酸的浓度大于0.01mol/L,无法判断溶液中c(CH3COO-)+c(CH3COOH)的大小,故C错误;
D.反应后的溶液为醋酸钠溶液,由于醋酸根离子部分水解,溶液中显示碱性,则c(OH-)>c(H+)、c(Na+)>c(CH3COO-),所以溶液中离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D错误;
故选AB.
B.pH=12的NaOH溶液中水电离的氢离子为溶液中的氢离子浓度:1×10-12mol/L,pH=2的醋酸溶液中,水电离的氢离子为溶液中的氢氧根离子浓度:1×10-12mol/L,所以两溶液中水电离的c(H+)=1×10-12mol?L-1,故B正确;
C.由于醋酸为弱电解质,溶液中氢离子浓度为0.01mol/L,则醋酸的浓度大于0.01mol/L,无法判断溶液中c(CH3COO-)+c(CH3COOH)的大小,故C错误;
D.反应后的溶液为醋酸钠溶液,由于醋酸根离子部分水解,溶液中显示碱性,则c(OH-)>c(H+)、c(Na+)>c(CH3COO-),所以溶液中离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D错误;
故选AB.
点评:本题考查了酸碱混合后的定性判断及溶液酸碱性与溶液pH的计算、离子浓度大小比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,明确根据电荷守恒、物料守恒、盐的水解原理比较溶液中各离子浓度大小的方法.

练习册系列答案
相关题目
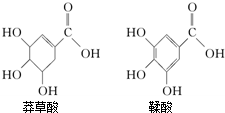 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物(如图)的说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物(如图)的说法正确的是( )| A、两种酸都能与溴水发生反应 |
| B、鞣酸分子与莽草酸分子相比多了两个碳碳双键 |
| C、1mol莽草酸完全燃烧消耗7mol O2 |
| D、等物质的量的两种酸与足量氢氧化钠反应,消耗氢氧化钠的量相同 |
下列说法正确的是( )
| A、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| B、氨水是弱碱,可用氨水与AlCl3溶液反应制Al(OH)3 |
| C、某些金属化合物具有特定的颜色,因此可制作烟花 |
| D、H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 |
下列各组,可以用树状分类法进行分类的是( )
| A、烧杯、烧碱、燃烧、烧瓶 |
| B、酒精、酒精灯、水、盐酸 |
| C、干冰、一氧化碳、石墨、金刚石 |
| D、H2、HCl、NaOH、NaHCO3 |
常温下,将a mL b mol/L CH3COOH溶液加入到c mL d mol/L NaOH溶液中.下列结论中,不正确的是( )
| A、如果ab=cd,则反应后溶液的pH>7 |
| B、如果a=c,且反应后溶液的pH<7,则b<d |
| C、如果a=c、b=d,则反应后的溶液中c(CH3COO-)<c(Na+) |
| D、如果反应后溶液的pH=7,则此溶液中c(CH3COO-)=c(Na+) |
以下用于研究有机物的方法错误的是( )
| A、蒸馏常用于分离提纯液态有机混合物 |
| B、燃烧法是研究确定有机物成分的有效方法 |
| C、核磁共振氢谱通常用于分析有机物的相对分子质量 |
| D、对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
下列反应的离子方程式不正确的是( )
| A、向漂白粉中通人少量的SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | ||||
| B、将CO2通入到纯碱饱和溶液中:2Na++CO32-+CO2+H2O═2NaHCO3↓ | ||||
| C、向Ba(OH)2溶液中加入足量的NaHCO3溶液:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | ||||
D、将饱和FeCl3溶液滴入沸水中制胶体:Fe3++3H2O
|
下列除去杂质的方法错误的是( )
| A、除去SiO2中少量NH4Cl:在空气中充分灼烧 |
| B、除去铜器表面的铜绿[Cu2(OH)2CO3]:用盐酸浸泡,再用清水冲洗 |
| C、除去CO2中混有的少量的HCl:用NaOH溶液洗气,再干燥 |
| D、除去FeCl2溶液中混有的CuCl2:可在溶液中加入铁粉,充分反应后过滤 |