题目内容
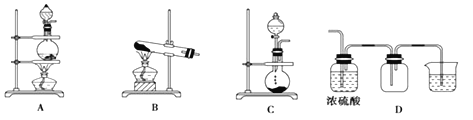
【题目】(1)实验室常用的几种气体发生装置如图A、B、C所示:
回答下列问题:
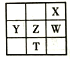
①若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的_____。
A.CO2 B.H2 C.Cl2 D.NH3
②D装置的小烧杯中应盛放NaOH溶液,目的是__________________。
③若要收集干净纯净的X气体,上述装置应如何改进____________________。
④若用B装置制取氨气可以用_________(填试剂名称)进行干燥。
(2)某化学兴趣小组为探究SO2的性质,按下图所示装置进行试验。

请回答下列问题:
①装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是_________、________。
②反应后,装置B中发生的现象是____________,装置D表现了SO2的_____性,装置E表现了SO2的______性。
③F装置漏斗的作用是_____________。
④装置C中发生的离子方程式________________________________。
【答案】C 尾气进行处理,防止污染环境 在装置A、 D之间增加一个盛有饱和食盐水的洗瓶 碱石灰(或CaO、Ca(OH)2等) 分液漏斗 圆底烧瓶 黄绿色逐渐变浅 氧化 漂白 防止倒吸 2MnO4-+5SO2+2H2O=5SO42-+2Mn2++4H+
【解析】
(1)A装置用于固体(液体)与液体反应加热制取气体,B装置是固体加热制取气体,C装置是固体(液体)与液体反应不需要加热制取气体,D装置浓硫酸干燥气体,收集密度比空气大的气体,最后尾气处理防止污染空气以此进行分析;
(2)A装置利用强酸制弱酸原理,将浓硫酸滴入圆底烧瓶与亚硫酸钠反应制取二氧化硫气体,B装置二氧化硫与氯水发生氧化还原反应,使溶液褪色,SO2+Cl2+2H2O=2HCl+H2SO4,C装置二氧化硫与酸性高锰酸钾发生氧化还原反应,使溶液褪色,2MnO4-+5SO2+2H2O=5SO42-+2Mn2++4H+,B、C装置均验证二氧化硫的还原性,D装置验证二氧化硫氧化性,SO2+2H2S=3S+2H2O,E装置验证二氧化硫的漂白性,F为尾气吸收装置,防止污染环境;
(1)①A装置用于固体(液体)与液体反应加热制取气体,D装置浓硫酸干燥气体,收集密度比空气大的气体,最后尾气处理防止污染空气以此进行分析;
A.大理石与盐酸反应制取二氧化碳不需要加热,故A不正确;
B.H2密度比空气小,故B不正确;
C.二氧化锰和浓盐酸加热制取氯气,浓硫酸干燥氯气,向上排空气法收集,尾气用碱液处理法,故C正确;
D.NH3不可用浓硫酸干燥,故D不正确;
答案:C
②D装置的小烧杯中应盛放NaOH溶液,因为氯气有毒,需要进行尾气处理,防止污染环境;
答案:尾气进行处理,防止污染环境
③因为浓盐酸易挥发,制得的氯气中混有氯化氢,应该在装置A、 D之间增加一个盛有饱和食盐水的洗瓶,除去氯气中的氯化氢,可以收集干净纯净的氯气;
答案:在装置A、 D之间增加一个盛有饱和食盐水的洗瓶
④氨气为碱性气体,不可以用酸性干燥剂;氨气还会与氯化钙反应,所以也不可用氯化钙,只能选择碱性干燥剂,例如碱石灰,生石灰等;
答案:碱石灰(或CaO、Ca(OH)2等)
(2)①装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是分液漏斗、圆底烧瓶;
答案:分液漏斗 圆底烧瓶
②装置B中发生反应为SO2+Cl2+2H2O=2HCl+H2SO4,现象是黄绿色逐渐变浅,装置D反应SO2+2H2S=3S+2H2O,表现了SO2的氧化性,装置E二氧化硫漂白品红溶液,表现了SO2的漂白性;
答案:黄绿色逐渐变浅 氧化 漂白
③F装置漏斗的作用是防止倒吸;
答案:防止倒吸
④装置C中高锰酸根离子将二氧化硫氧化为硫酸根离子,发生的离子方程式2MnO4-+5SO2+2H2O=5SO42-+2Mn2++4H+;
答案:2MnO4-+5SO2+2H2O=5SO42-+2Mn2++4H+

 黄冈创优卷系列答案
黄冈创优卷系列答案